题目内容
15.下列叙述正确的是( )| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 元素非金属性:F>O>N>C | D. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 |
分析 A.H原子半径最小,同周期随原子序数增大,原子半径减小;
B.同周期随原子序数增大,非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
C.同周期随原子序数增大,非金属性增强;
D.非金属的非金属性越强,其最高价含氧酸的酸性越强.
解答 解:A.H原子半径最小,Na、Mg、Al同周期,随原子序数增大原子半径减小,故原子半径H<Al<Mg<Na,故A错误;
B.同周期随原子序数增大,非金属性增强,同主族自上而下非金属性减弱,故非金属性Cl>S>P>As,非金属性越强,氢化物越稳定,故氢化物稳定性HCl>H2S>PH3>AsH3,故B错误;
C.C、N、O、F同周期,随原子序数增大,非金属性增强,故C正确;
D.同一周期中,元素的非金属性随着原子序数的增大而增大,所以非金属性Cl>S>P,同一主族,原子序数越大,非金属性越小,故非金属性C>Si,故D错误;故选C.
点评 本题考查金属性与非金属性的比较方法,明确元素周期律是解本题的关键,注意总结规律,难度不大.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 金属Li、Na、K密度较小,应保存在煤油中 | |
| B. | CuO、Na2O、Mn2O7属于碱性氧化物 | |
| C. | SO2具有漂白性,可使溴水褪色 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4会产生沉淀而后沉淀溶解 |
4.某饱和一氯代烷3.70g与足量的NaOH水溶液混合加热后,用HNO3酸化,再加入足量AgNO3溶液,生成白色沉淀5.74g.则该卤代烃的分子式为:C4H9Cl,这种一氯代物的同分异构体种类有4种.
5.合成氨反应N2(g)+3H2(g)?2NH3(g),已知H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N-H键能为39IkJ/mol,则该反应的反应热△H为( )
| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
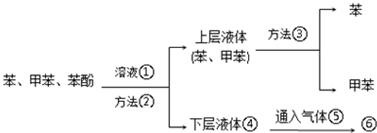
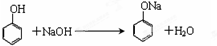 .
. .
.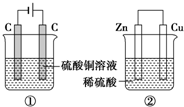 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
 .
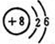
.
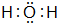 、
、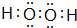 ,属于共价化合物.
,属于共价化合物.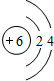 .
.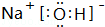 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.