题目内容
13.几种短周期元素的原子半径及主要化合价如表( )| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
分析 短周期元素中,P有+7、-1价,则P为Cl;M有-2价,处于VIA族,原子半径小于Cl,故M为O元素;Z有+5、-3价,处于VA族,原子半径小于Cl,则Z为N元素;Y有+3价,原子半径大于Cl,故Y为Al;X、N均有+1价,处于IA族,原子半径X>N>Al,故X为Na、N为Li.
解答 解:短周期元素中,P有+7、-1价,则P为Cl;M有-2价,处于VIA族,原子半径小于Cl,故M为O元素;Z有+5、-3价,处于VA族,原子半径小于Cl,则Z为N元素;Y有+3价,原子半径大于Cl,故Y为Al;X、N均有+1价,处于IA族,原子半径X>N>Al,故X为Na、N为Li.
A.同主族自上而下金属性减弱,故金属性X(Na)>N(Li),故A正确;
B.Y、M元素形成的离子化合物是氧化铝,工业上电解熔融的氧化铝冶炼Al,故B正确;
C.X单质在M单质中燃烧生成的化合物为Na2O2,由钠离子与过氧根离子构成,39g过氧化钠物质的量为0.5mol,共含有0.5NA个阴离子,故C正确;
D.表中Z元素的最高价氧化物的水化物的分子式可表示为HNO3,故D错误.
故选:D.
点评 本题考查结构性质位置关系应用,根据化合价及原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
4.某饱和一氯代烷3.70g与足量的NaOH水溶液混合加热后,用HNO3酸化,再加入足量AgNO3溶液,生成白色沉淀5.74g.则该卤代烃的分子式为:C4H9Cl,这种一氯代物的同分异构体种类有4种.
5.合成氨反应N2(g)+3H2(g)?2NH3(g),已知H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N-H键能为39IkJ/mol,则该反应的反应热△H为( )
| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
2.下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥离子化合物在熔融状态能导电.
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥离子化合物在熔融状态能导电.
| A. | ①③⑥ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑤ |
3.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | CH3OH转变成H2的过程一定要吸收能量 | |
| C. | 可推知2H2(g)+O2(g)═2H2O(g)△H=-483.8 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H<-192.9kJ•mol-1 |
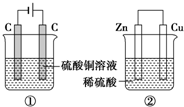 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
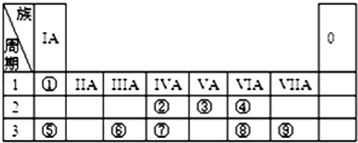
 ,Y中含有的化学键类型是共价键.
,Y中含有的化学键类型是共价键.