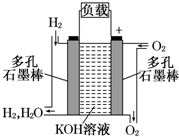
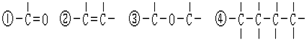题目内容
11.设nA为阿佛加德罗常数的数值,下列说法正确的是( )| A. | 1mol/LNaCl溶液含有nA个Na+ | |
| B. | 0.1molOH-含nA个电子 | |
| C. | 1molCu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 常温常压下,22.4LCO2中含有nA个CO2分子 |
分析 A、溶液体积不明确;
B、氢氧根为10电子微粒;
C、铜反应后变为+2价,根据得失电子数守恒来分析;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、溶液体积不明确,故溶液中钠离子的个数无法计算,故A错误;
B、氢氧根为10电子微粒,故0.1mol氢氧根中含nA个,故B正确;
C、铜反应后变为+2价,故1mol铜失去2mol电子,设生成的NO的物质的量为xmol,则有:2mol=xmol×3,则解得x=$\frac{2}{3}$mol,即生成NO分子个数为$\frac{2}{3}{N}_{A}$个,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,则分子个数小于nA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
1. 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号).
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
19.常温下取pH均等于1的硫酸和醋酸各10ml,分别稀释10倍后,再分别加入0.07g锌粉充分反应,有关叙述正确的是( )
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
3.下列说法中,不正确的是( )
| A. | 铝是地壳中含量最多的元素 | B. | 铁是人类冶炼最多的金属 | ||
| C. | 汞是所有金属中熔点最低的 | D. | 钙是人体内最多的金属元素 |
1.组成和结构可用 表示的有机物,能在一定条件下发生消去反应的共有( )
表示的有机物,能在一定条件下发生消去反应的共有( )
 表示的有机物,能在一定条件下发生消去反应的共有( )
表示的有机物,能在一定条件下发生消去反应的共有( )| A. | 5 种 | B. | 10种 | C. | 20 种 | D. | 30种 |