题目内容
2.有机物A的分子式为CaHb02,其中氧的质量分数约为18.6%,A在酸性条件下水解生成B 和C两种有机物且B在一定条件氧化生成C,则A的结构可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 分子式为CaHbO2的有机物A,通过氧的质量分数约为18.6%,可以计算出A的相对分子质量,A在酸性条件下水解生成有机物B和C,所以A是酯,且只含一个酯基;根据B在一定条件氧化生成C,说明B和C的碳原子数相同,且碳链相同,判断B为醇C为羧酸且B中含有-CH2OH结构,以此解答该题.
解答 解:分子式为CaHbO2的有机物A,通过氧的质量分数约为18.6%,计算出A的相对分子质量M(A)=$\frac{2×16}{18.6%}$=172,因相对分子质量为172,其中含有2个氧原子则C和H相对原子质量之和为140,可以推出C原子数为10或者11个,但因为B氧化得到C所以C原子数目应该为10,可以推出A的分子式为C10H20O2.由分子式推出A为饱和酯,A在酸性条件下水解生成B 和C两种有机物且B在一定条件氧化生成C,可以得出B为醇C为羧酸,可知B和C碳链相同且且B中含有-CH2OH结构,所以本题就变成分析C4H9-的同分异构情况,丁基的结构有4种:C-C-C-C-, ,
, ,所以A得结构一共有4种,故选B.
,所以A得结构一共有4种,故选B.
点评 本题考查了有机物分子的推算,同分异构体的书写方法,题目难度不大,注意根据B转化为C的性质和C4H9-的同分异构体的种类判断,明确同分异构体的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 标准状况下,22.4L N2和H2的混合气中含NA个原子 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
13.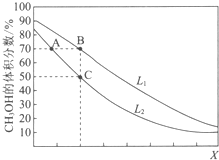 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )| A. | X代表压强 | B. | L1<L2 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
10.主族元素R最外层电子数为5,则下列说法正确的是( )
| A. | R一定是非金属元素 | B. | R的最高价氧化物为R2O5 | ||
| C. | 最高价氧化物对应水化物H2RO4 | D. | R的气态氢化物为RH5 |
17.各为50mL的H2SO4和CH3COOH两种溶液中,测得c(H+)都等于0.2mol/L.向两份酸中各加入Zn粉,结果产生H2的体积比为3:4,下列说法中,一定正确的是( )
| A. | 参加反应的Zn质量一定相等 | B. | 硫酸反应完全,CH3COOH有剩余 | ||
| C. | 两种酸都有剩余 | D. | 参加反应的Zn的质量比为3:4 |
7.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2可以氧化Ni(OH)2.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
试回答相关问题:
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式),调节过程中pH不能低于4.2.
(2)写出加入Na2C2O4溶液的反应的化学方程式NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)写出流程中,通入Cl2发生“氧化”反应的离子方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(4)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2可以氧化Ni(OH)2.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式),调节过程中pH不能低于4.2.
(2)写出加入Na2C2O4溶液的反应的化学方程式NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)写出流程中,通入Cl2发生“氧化”反应的离子方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(4)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
14.在医院中,为酸中毒病人输液不应采用( )
| A. | 5%葡萄糖溶液 | B. | 0.9%氯化钠溶液 | ||
| C. | 1.25%碳酸氢钠溶液 | D. | 0.9%氯化铵溶液 |
11.设nA为阿佛加德罗常数的数值,下列说法正确的是( )
| A. | 1mol/LNaCl溶液含有nA个Na+ | |
| B. | 0.1molOH-含nA个电子 | |
| C. | 1molCu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 常温常压下,22.4LCO2中含有nA个CO2分子 |