题目内容
依据叙述,写出下列反应的热化学方程式.
(1)在25℃、10lkPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 .
(2)1mol N2和适量的O2完全反应生成NO2需要吸收68kJ热量.其热化学方程式为 .
(3)已知C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1 CO(g)+
O2(g)=2CO2(g)△H=-283.0 KJ?mol-1则碳与O2生成CO的热化学方程式 .
(4)已知拆开1mol H-H键、1mol N-H键、1mol N-N键分别需要的能量是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
(1)在25℃、10lkPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
(2)1mol N2和适量的O2完全反应生成NO2需要吸收68kJ热量.其热化学方程式为
(3)已知C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1 CO(g)+
| 1 |
| 2 |
(4)已知拆开1mol H-H键、1mol N-H键、1mol N-N键分别需要的能量是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,根据燃烧热的概念分析即可解答;
(2)书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意必须注明各反应物、生成物的状态(s、l、g、aq)等要求,根据热化学方程式的书写方法解答;
(3)根据C(石墨)、CO(g)燃烧的热化学方程式,利用盖斯定律可求的热化学方程式;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意必须注明各反应物、生成物的状态(s、l、g、aq)等要求,根据热化学方程式的书写方法解答;
(3)根据C(石墨)、CO(g)燃烧的热化学方程式,利用盖斯定律可求的热化学方程式;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:
解:(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1,
故答案为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1;
(2)1mol N2 (g)与适量O2(g)起反应,生成NO2(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1;
(3)①C(石墨)+O2(g)═CO2(g)△H=-393.51KJ/mol
②CO(g)+
O2(g)═CO2(g)△H=-283.0KJ/mol
依据盖斯定律计算①-②得到:C(石墨)+
O2(g)═CO(g)△H=-110.51KJ/mol;
故答案为:C(石墨)+
O2(g)═CO(g)△H=-110.51KJ/mol;
(4)反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2252kJ=92kJ,则标注物质聚集状态和对应焓变写出热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)1mol N2 (g)与适量O2(g)起反应,生成NO2(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1;
(3)①C(石墨)+O2(g)═CO2(g)△H=-393.51KJ/mol
②CO(g)+
| 1 |
| 2 |
依据盖斯定律计算①-②得到:C(石墨)+
| 1 |
| 2 |
故答案为:C(石墨)+
| 1 |
| 2 |
(4)反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2252kJ=92kJ,则标注物质聚集状态和对应焓变写出热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1.
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,盖斯定律的运用.题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
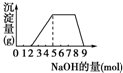 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:[已知:Mg2++2OH-═Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于水;NH4++OH-═NH3?H2O]由此可知,该溶液中肯定含有的离子是
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:[已知:Mg2++2OH-═Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于水;NH4++OH-═NH3?H2O]由此可知,该溶液中肯定含有的离子是