题目内容
有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-.取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据第(1)步实验,可确定溶液中一定不存在的离子是 ;根据上述全部实验事实,确定该溶液中肯定含有的离子是 ;针对还不能确定是否存在的阳离子,可以采取的检验方法是 .
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据第(1)步实验,可确定溶液中一定不存在的离子是
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:有一瓶澄清的溶液,其中可能含有H+、NH4+、K+,Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-.取该溶液进行以下实验:
①用pH试纸检验,表明溶液为强酸性;排除CO32-的存在;
②另取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色,说明含有I-;则不能含有Fe3+,因为I-具有还原性,Fe3+具有氧化性;
③另取部分溶液,加入稀NaOH溶液使其变成碱性,溶液中无沉淀生成;证明一定不存在Mg2+;
④取部分上述碱性溶液,加入Na2CO3溶液有白色沉淀生成;证明Ba2+存在,一定不含SO42-;
⑤将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝,此气体为氨气,故一定存在NH 4+,据此分析解答即可.
①用pH试纸检验,表明溶液为强酸性;排除CO32-的存在;
②另取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色,说明含有I-;则不能含有Fe3+,因为I-具有还原性,Fe3+具有氧化性;
③另取部分溶液,加入稀NaOH溶液使其变成碱性,溶液中无沉淀生成;证明一定不存在Mg2+;
④取部分上述碱性溶液,加入Na2CO3溶液有白色沉淀生成;证明Ba2+存在,一定不含SO42-;
⑤将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝,此气体为氨气,故一定存在NH 4+,据此分析解答即可.
解答:
解:①溶液呈强酸性,所以溶液中不存在与强酸反应的CO32-离子;
②碘离子能和氯水反应生成碘单质,碘在四氯化碳中呈紫色,通过实验现象判断,溶液中含有I-,由于碘离子与铁离子发生氧化还原反应,故不存在Fe3+;
③镁离子和氢氧化钠反应生成沉淀,通过实验现象判断,溶液中不存在与氢氧根离子反应生成沉淀的Mg2+;
④钡离子和碳酸钠反应生成白色沉淀,通过实验现象判断,溶液中有与Na2CO3溶液反应生成白色沉淀的Ba2+,如果有Ba2+离子,溶液中就没有SO42-;
⑤铵根离子在加热条件下与氢氧化钠反应生成能使湿润的红色石蕊试纸变蓝色的氨气,这是铵根离子的特征反应;通过实验现象判断,溶液中有NH4+,
通过以上现象不能判断溶液中是否含有K+、Na+、Cl-;故通过焰色反应可以继续确定,若焰色反应为黄色,则含有钠离子,若焰色反应为紫色,则含有钾离子,故一定含有的离子为NH4+、Ba2+、I-;一定不含有Mg2+、Fe3+、SO42-、CO32-;故答案为:Mg2+、Fe3+、SO42-、CO32-;I-、NH4+、Ba2+;焰色反应.
②碘离子能和氯水反应生成碘单质,碘在四氯化碳中呈紫色,通过实验现象判断,溶液中含有I-,由于碘离子与铁离子发生氧化还原反应,故不存在Fe3+;
③镁离子和氢氧化钠反应生成沉淀,通过实验现象判断,溶液中不存在与氢氧根离子反应生成沉淀的Mg2+;
④钡离子和碳酸钠反应生成白色沉淀,通过实验现象判断,溶液中有与Na2CO3溶液反应生成白色沉淀的Ba2+,如果有Ba2+离子,溶液中就没有SO42-;
⑤铵根离子在加热条件下与氢氧化钠反应生成能使湿润的红色石蕊试纸变蓝色的氨气,这是铵根离子的特征反应;通过实验现象判断,溶液中有NH4+,
通过以上现象不能判断溶液中是否含有K+、Na+、Cl-;故通过焰色反应可以继续确定,若焰色反应为黄色,则含有钠离子,若焰色反应为紫色,则含有钾离子,故一定含有的离子为NH4+、Ba2+、I-;一定不含有Mg2+、Fe3+、SO42-、CO32-;故答案为:Mg2+、Fe3+、SO42-、CO32-;I-、NH4+、Ba2+;焰色反应.
点评:考查的是常见离子的检验,要注意的是:焰色反应是元素的性质不是单质的性质,要观察钾元素的焰色反应时,必须透过蓝色钴玻璃,除去钠元素的干扰,才能观察到钾元素焰色反应的颜色.题目难度中等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、先加入KSCN溶液无明显现象,再加入氯水,溶液变血红色,一定有Fe2+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
某无色溶液可能含有Na+、Ba2+、Al3+、Fe3+、Br-、CO32-等离子,取少量往其中滴加氯水,有无色无味气体产生,溶液仍为无色;另取少量逐滴滴入NaOH溶液至过量,无现象.关于该溶液的推测正确的是( )
| A、溶液中可能存在Al3+ |
| B、溶液中可能存在Br- |
| C、溶液中一定存在CO32- |
| D、溶液可能存在Ba2+ |
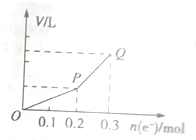 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.05molCu2(OH)2CO3 |
下列体系加压后,对化学反应速率没有影响的是( )
| A、2SO2+O2?2SO3 |
| B、CO+H2O(g)?CO2+H2 |
| C、CO2+H2O?H2CO3 |
| D、H++OH-?H2O |
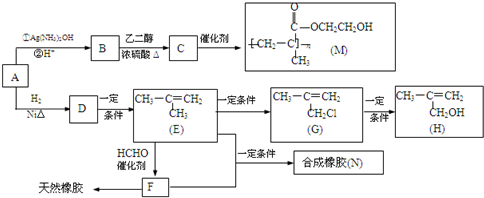
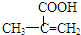 ,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式
,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式