题目内容
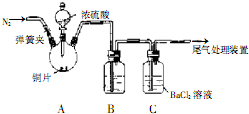
有一瓶无色澄清的溶液,可能由以下离子中的几种组成:SO32-、I-、CO32-、Cl-、SO42-、Fe2+、Na+、MnO4-请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B.
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C.
步骤三:往C溶液中通入足量Cl2,得黄色溶液D.
(1)该溶液中一定存在的离子是: .
(2)该溶液中可能存在的阴离子是: .
(3)步骤三中溶液变黄可能是因为生成了: (填化学式);确认其存在的实验操作与现象是:取适量D溶液于试管中, .
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B.
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C.
步骤三:往C溶液中通入足量Cl2,得黄色溶液D.
(1)该溶液中一定存在的离子是:
(2)该溶液中可能存在的阴离子是:
(3)步骤三中溶液变黄可能是因为生成了:
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:该溶液为无色溶液,说明没有Fe2+、MnO4-,由于溶液的电中性,必须有阳离子,所以存在Na+;取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B;说明一定有SO32-,生成SO2,可能有CO32-,生成CO2,往B中加入足量BaCl2溶液,得白色沉淀和溶液C,说明一定有SO42-,往C中加入足量氯水,得黄色溶液D.溶液变为黄色,说明一定含有I-,据此分析即可解答.
解答:
解:Fe2+在溶液中为浅绿色,该溶液为无色溶液,说明没有Fe2+;由于溶液的电中性,必须有阳离子,所以存在Na+;二氧化硫有刺激性,取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B;说明一定有SO32-,生成SO2,可能有CO32-,生成CO2,往B中加入足量BaCl2溶液,得白色沉淀和溶液C,说明一定有SO42-,生成了硫酸钡沉淀;氯水能氧化碘离子,往C中加入足量氯水,得黄色溶液D,溶液变为黄色,说明一定含有I-,
(1)由以上分析可知,溶液中一定存在的是:Na+、SO32-、SO42-、I-,故答案为:Na+、SO32-、SO42-、I-;
(2)溶液中可能存在的阴离子是:CO32-、Cl-,故答案为:CO32-、Cl-;
(3)Fe2+在溶液中为浅绿色,该溶液为无色溶液,说明没有Fe2+,氯水能氧化碘离子,往C中加入足量氯水,得黄色溶液是由于氯气氧化碘离子生成碘单质,碘单质遇淀粉变蓝,故可以加入淀粉溶液,溶液若变蓝,则含有碘单质,故答案为:I2;加入淀粉溶液,溶液若变蓝,则含有碘单质.
(1)由以上分析可知,溶液中一定存在的是:Na+、SO32-、SO42-、I-,故答案为:Na+、SO32-、SO42-、I-;
(2)溶液中可能存在的阴离子是:CO32-、Cl-,故答案为:CO32-、Cl-;
(3)Fe2+在溶液中为浅绿色,该溶液为无色溶液,说明没有Fe2+,氯水能氧化碘离子,往C中加入足量氯水,得黄色溶液是由于氯气氧化碘离子生成碘单质,碘单质遇淀粉变蓝,故可以加入淀粉溶液,溶液若变蓝,则含有碘单质,故答案为:I2;加入淀粉溶液,溶液若变蓝,则含有碘单质.
点评:本题考查常见离子的检验,切入点是实验现象,根据实验现象结合离子的性质综合分析检验离子是解答本题的关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份200mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2=H2O+NO2↑+NO↑)
①第一份加足量AgNO3溶液后,有11.68g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100mL0.5mol?L-1的稀硫酸恰好完全吸收,酸也不剩余.根据上述实验,以下推测不正确的是( )
①第一份加足量AgNO3溶液后,有11.68g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100mL0.5mol?L-1的稀硫酸恰好完全吸收,酸也不剩余.根据上述实验,以下推测不正确的是( )
| A、原溶液一定不存在较大浓度的H+、Mg2+ |
| B、原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1 |
| C、不能确定原溶液是否含有K+、NO3- |
| D、实验中产生的棕色气体遇空气颜色会加深 |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、先加入KSCN溶液无明显现象,再加入氯水,溶液变血红色,一定有Fe2+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
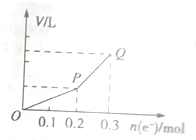 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.05molCu2(OH)2CO3 |
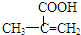 ,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式
,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.