题目内容
9. 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
分析 该电池中铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,氧化银做正极,得电子被还原为Ag,据此书写方程式.
解答 解:铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,所以其电池反应式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,
故答案为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
点评 本题考查化学电源新型电池,题目难度中等,解答本题的关键是能正确分析正负极的反应,做题时注意体会书写方法.

练习册系列答案
相关题目
17.下列指定反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 向0.1mol/L pH=1的KHA溶液中加入KOH溶液:H++OH-═H2O | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
4.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO(g)+Cl2(g)?2NOCl(g),在2L恒温密闭容器中分别进行实验①和实验②,部分实验数据见下表:下列说法中不正确的是( )
| 实验编号 | 反应条件 | 时间 | NO/mol | Cl2/mol | NOCl/mol |
| 实验① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 实验② | T、恒压 | 初始 | 0.2 | 0.1 | 0 |
| A. | 实验①中,0~10min内,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡时若升高温度,达到新平衡时K=400,则该反应△H>0 | |
| C. | 平衡时实验②比实验①的Cl2转化率大 | |
| D. | 若实验①起始只充入0.4molNOCl,则平衡时NOCl浓度大于0.15mol•L-1 |
11.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知实验中可能会发生下列反应:
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).
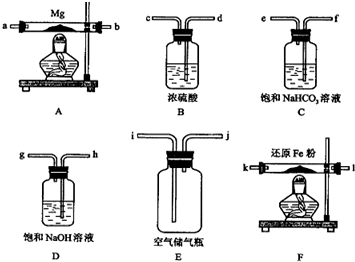
回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
(2)连接并检查实验装置的气密性.实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)j→h→g→d→c→k→l(或l→k)→a→b (或b→a);
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).

回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 | 目的 |
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
9.固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是( )
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
