题目内容
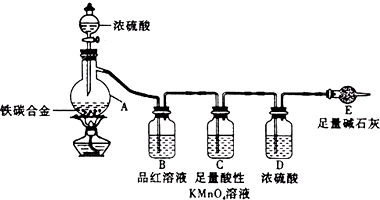 某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质
某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质(1)按图示的连接装置,检查装置的气密性,称量E的质量.
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸.仪器A的名称为
未点燃酒精灯前,A、B均无明显现象,其原因是:
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象.写出A中发生反应的化学方程式
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是
Ⅱ测定铁的质量分数
(5)装置C的作用
考点:浓硫酸的性质实验
专题:氧族元素
分析:(2)仪器A为蒸馏烧瓶;常温下,Fe在浓硫酸中发生钝化,碳不与浓硫酸反应;
(3)铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁和二氧化硫水;碳和浓硫酸加热反应生成二氧化碳二氧化硫水,依据书写化学方程式的原则写出;B中品红的红色褪去是利用了二氧化硫的漂白性;通过现象证明浓硫酸生成了二氧化硫,表现了强氧化性;
(4)铁、碳在硫酸溶液中形成原电池,能加快化学反应速率;
(5)二氧化硫具有还原性,能被高锰酸钾氧化为硫酸根离子,装置C的作用是除去二氧化硫;D的作用是除去水蒸气,干燥二氧化碳;根据mg铁碳合金,加入过量浓硫酸,气体通过浓硫酸干燥后通入干燥管E,E中所装试剂为碱石灰,可吸收CO2;E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数;
(6)根据空气中的二氧化碳和水蒸气也会进入E装置.
(3)铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁和二氧化硫水;碳和浓硫酸加热反应生成二氧化碳二氧化硫水,依据书写化学方程式的原则写出;B中品红的红色褪去是利用了二氧化硫的漂白性;通过现象证明浓硫酸生成了二氧化硫,表现了强氧化性;
(4)铁、碳在硫酸溶液中形成原电池,能加快化学反应速率;
(5)二氧化硫具有还原性,能被高锰酸钾氧化为硫酸根离子,装置C的作用是除去二氧化硫;D的作用是除去水蒸气,干燥二氧化碳;根据mg铁碳合金,加入过量浓硫酸,气体通过浓硫酸干燥后通入干燥管E,E中所装试剂为碱石灰,可吸收CO2;E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数;
(6)根据空气中的二氧化碳和水蒸气也会进入E装置.
解答:
解:(2)仪器A为蒸馏烧瓶;常温下,Fe在浓硫酸中发生钝化,碳不与浓硫酸反应,没有二氧化硫生成,故A、B均无明显现象,
故答案为:蒸馏烧瓶;常温下,Fe在浓硫酸中发生钝化,碳不与浓硫酸反应;
(3)铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁和二氧化硫水;碳和浓硫酸加热反应生成二氧化碳二氧化硫水,方程式分别为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O或C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;B中品红的红色褪去是利用了二氧化硫的漂白性;通过现象证明浓硫酸生成了二氧化硫,表现了强氧化性,
故答案为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;品红溶液逐渐褪色;强氧化;
(4)铁、碳在酸溶液中符合原电池的组成条件,形成原电池反应,能加快化学反应速率;
故答案为:铁、碳在酸溶液中形成原电池;
(5)装置C的作用是除去二氧化硫;D的作用是除去水蒸气,干燥二氧化碳;称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量=
×12g/mol=
g,则含铁的质量为mg-
g,铁的质量分数=
×100%=
×100%;
故答案为:除去二氧化硫;干燥二氧化碳;
×100%;
(6)空气中的二氧化碳和水蒸气也会进入E装置,所以在E装置后再接一个盛有碱石灰的干燥管;
故答案为:在E装置后再接一个盛有碱石灰的干燥管,以空气中的二氧化碳和水蒸气也会进入E装置.
故答案为:蒸馏烧瓶;常温下,Fe在浓硫酸中发生钝化,碳不与浓硫酸反应;
(3)铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁和二氧化硫水;碳和浓硫酸加热反应生成二氧化碳二氧化硫水,方程式分别为:2Fe+6H2SO4(浓)
| ||
| ||
故答案为:2Fe+6H2SO4(浓)
| ||
| ||
(4)铁、碳在酸溶液中符合原电池的组成条件,形成原电池反应,能加快化学反应速率;
故答案为:铁、碳在酸溶液中形成原电池;
(5)装置C的作用是除去二氧化硫;D的作用是除去水蒸气,干燥二氧化碳;称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量=
| bg |
| 44g/mol |
| 3b |
| 11 |
| 3b |
| 11 |
m-
| ||
| a |
| 11m-3b |
| 11m |
故答案为:除去二氧化硫;干燥二氧化碳;
| 11m-3b |
| 11m |
(6)空气中的二氧化碳和水蒸气也会进入E装置,所以在E装置后再接一个盛有碱石灰的干燥管;
故答案为:在E装置后再接一个盛有碱石灰的干燥管,以空气中的二氧化碳和水蒸气也会进入E装置.
点评:本题考查了物质性质的探究实验,装置分析,流程反应和试剂作用是解题关键,题目难度中等,熟悉装置及装置中每部分的作用是解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、石油分馏和煤的干馏都是物理变化 |
| B、棉与蚕丝完全燃烧都只生成CO2和H2O |
| C、淀粉和纤维素水解的最终产物都是葡萄糖 |
| D、鸡蛋清溶液中加入CuSO4溶液会发生盐析 |
下列实验操作中,正确的是( )
| A、为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
| B、用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上 |
| C、为加速固体物质的溶解只能采用加热的方法 |
| D、为增大气体物质的溶解度,常采取搅拌、加热等措施 |
根据有机化合物的命名原则,下列命名正确的是( )
A、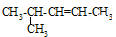 2-甲基-3-戊烯 |
B、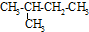 异丁烷 |
| C、CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| D、CH3CH(NO2)CH2COOH 3-硝基丁酸 |
下列各组溶液,只用试管和胶头滴管,不用任何试剂不可以鉴别的是( )
| A、CaCl2和Na2CO3 |
| B、稀H2SO4和Na2CO3 |
| C、KOH和Al2(SO4)3 |
| D、HCl NaAlO2 |
可用来鉴别己烯、甲苯、乙酸乙酯和苯酚溶液的一组试剂是( )
| A、浓溴水、氯化铁溶液 |
| B、浓溴水、酸性高锰酸钾溶液 |
| C、浓溴水、碳酸钠溶液 |
| D、氯化铁溶液、酸性高锰酸钾溶液 |
