题目内容
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于 (选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是 、 .
(3)反应TiCl4+2Mg═2MgCl2+Ti在Ar气氛中进行的理由是 .
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g)△H1=-72kJ?mol-1
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1
C(s)+CO2(g)═2CO(g)?△H3=+282.8kJ?mol-1
反应C(s)+O2(g)═CO2(g)的△H= .

回答下列问题:
(1)钛铁矿和浓硫酸反应属于
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是
(3)反应TiCl4+2Mg═2MgCl2+Ti在Ar气氛中进行的理由是
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g)△H1=-72kJ?mol-1
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1
C(s)+CO2(g)═2CO(g)?△H3=+282.8kJ?mol-1
反应C(s)+O2(g)═CO2(g)的△H=
考点:物质分离和提纯的方法和基本操作综合应用,热化学方程式
专题:实验设计题,化学反应中的能量变化
分析:以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,钛铁矿石加入浓硫酸,钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O,加入水溶解后加入铁防止亚铁离子被氧化,沉降分离得到溶液Ⅰ,冷却结晶得到硫酸亚铁晶体,过滤得到溶液Ⅱ为TiOSO4,加热过滤得到滤液为硫酸,沉淀为钛酸煅烧得到二氧化钛,加入氯气和焦炭高温反应,由二氧化钛制取四氯化钛,加入镁反应在Ar气氛中进行,发生的反应为;TiCl4+2Mg═2MgCl2+Ti;
(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)根据盖斯定律来计算化学反应的焓变;
(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)根据盖斯定律来计算化学反应的焓变;
解答:
解:(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸;
故答案为:Fe;绿矾和硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行;
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ?mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ?mol-1-282.8kJ?mol-1-38.8kJ?mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸;
故答案为:Fe;绿矾和硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行;
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ?mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ?mol-1-282.8kJ?mol-1-38.8kJ?mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;
点评:本题考查学生化学反应的方向以及元素化合物的性质知识,注意知识的归纳和整理是解题的关键,难度中等.

练习册系列答案
相关题目
下列物质中不属于有机物的是( )
| A、醋酸 | B、碳酸钠 | C、酒精 | D、苯 |
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- |



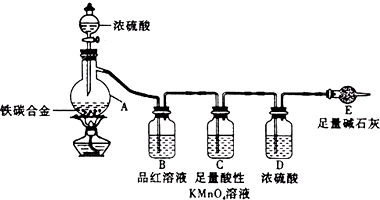 某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质
某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质