题目内容
二氧化硫是中学化学中常见的物质,实验室可用下列两种方案制备.
方案一:亚硫酸钠(Na2SO3)固体和80%硫酸溶液在常温下通过复分解反应制得;
方案二:金属铜与浓硫酸在加热条件下反应制得.
(1)方案一中选用80%硫酸而不选用稀硫酸的原因 .
(2)对比这两个方案,方案一明显有两个优点: 、 .
(3)为验证二氧化硫的还原性,某化学兴趣小组设计如下实验:将方案一生成的少量二氧化硫通入0.1ml/L Fe(NO3)2溶液中,充分反应后滴加BaCl2溶液有白色沉淀生成.该小组同学为进一步探究最先氧化SO2的成分,提出了如下假设,请你完成假设二:
假设一:是Fe3+最先氧化SO2;
假设二:是 最先氧化SO2;
(4)设计实验方案验证假设:(已知Cl-、Na+对Fe3+、NO3-的氧化性没有影响)
限选试剂和用品:0.1mol/LFeCl3溶液、0.1mol/LNaNO3溶液、0.3nol/LNaNO3溶液、盐酸、硝酸、溶有二氧化硫的品红溶液、pH试纸.
(5)思考与交流:有同学认为NO3-在酸性条件下的氧化性强于Fe3+,那么Fe2+与NO3-在酸性溶液中不能大量共存,你是否同意他的观点? ,试说明理由 .
方案一:亚硫酸钠(Na2SO3)固体和80%硫酸溶液在常温下通过复分解反应制得;
方案二:金属铜与浓硫酸在加热条件下反应制得.
(1)方案一中选用80%硫酸而不选用稀硫酸的原因
(2)对比这两个方案,方案一明显有两个优点:
(3)为验证二氧化硫的还原性,某化学兴趣小组设计如下实验:将方案一生成的少量二氧化硫通入0.1ml/L Fe(NO3)2溶液中,充分反应后滴加BaCl2溶液有白色沉淀生成.该小组同学为进一步探究最先氧化SO2的成分,提出了如下假设,请你完成假设二:
假设一:是Fe3+最先氧化SO2;
假设二:是
(4)设计实验方案验证假设:(已知Cl-、Na+对Fe3+、NO3-的氧化性没有影响)
限选试剂和用品:0.1mol/LFeCl3溶液、0.1mol/LNaNO3溶液、0.3nol/LNaNO3溶液、盐酸、硝酸、溶有二氧化硫的品红溶液、pH试纸.
| 实验步骤 | ①室温下,分别取等体积0.1mol/L FeCl3溶液与 |
| ② | |
| ③ | |
| 预期现象和结论 |
考点:浓硫酸的性质实验
专题:实验设计题
分析:(1)根据80%硫酸能降低二氧化硫在水中的溶解度;
(2)根据方案一不需要加热,节约能源以及制取等量的二氧化硫消耗的硫酸更少;
(3)根据NO3-也有强氧化性;
(4)①根据比较不同离子的氧化性,确保离子浓度相同;
②根据氢离子浓度能影响物质的氧化性;
③同时滴加等量的溶有二氧化硫的品红溶液,观察现象;
根据溶液先变红,则含有的离子先氧化;
(5)与溶液的酸碱性强弱有关,酸性条件下NO3-具有强氧化性.
(2)根据方案一不需要加热,节约能源以及制取等量的二氧化硫消耗的硫酸更少;
(3)根据NO3-也有强氧化性;
(4)①根据比较不同离子的氧化性,确保离子浓度相同;
②根据氢离子浓度能影响物质的氧化性;
③同时滴加等量的溶有二氧化硫的品红溶液,观察现象;
根据溶液先变红,则含有的离子先氧化;
(5)与溶液的酸碱性强弱有关,酸性条件下NO3-具有强氧化性.
解答:
解:(1)二氧化硫易溶于水,采用80%硫酸能降低二氧化硫在水中的溶解度;
故答案为:因为二氧化硫易溶于水;
(2)方案一不需要加热,节约能源,制取等量的二氧化硫消耗的硫酸更少;
故答案为:节约能源;制取等量的二氧化硫耗酸更少;
(3)NO3-也有强氧化性,也可氧化SO2;
故答案为:NO3-;
(4)①比较不同离子的氧化性,确保离子浓度相同,则加入0.1mol/LNaNO3溶液于试管中;
故答案为:0.1;
②氢离子浓度能影响物质的氧化性,则先测0.1mol/L FeCl3溶液的pH,再用盐酸调节0.3mol/L NaNO3溶液的pH与其相同;
故答案为:先测0.1mol/L FeCl3溶液的pH,再用盐酸调节0.3mol/L NaNO3溶液的pH与其相同;
③同时滴加等量的溶有二氧化硫的品红溶液;
故答案为:向A、B试管中滴加等量的溶有二氧化硫的品红溶液;
预期现象和结论:若A试管溶液先变红,则是Fe3+最先氧化SO2;若B试管溶液先变红,则是NO3-最先氧化SO2;
故答案为:若A试管溶液先变红,则是Fe3+最先氧化SO2;若B试管溶液先变红,则是NO3-最先氧化SO2;
(5)NO3-在酸性条件下的氧化性强于Fe3+,Fe2+与NO3-在酸性溶液中不能大量共存,该观点正确,NO3-的强氧化性与溶液的酸碱性强弱有关;
故答案为:正确;与溶液的酸碱性强弱有关.
故答案为:因为二氧化硫易溶于水;
(2)方案一不需要加热,节约能源,制取等量的二氧化硫消耗的硫酸更少;
故答案为:节约能源;制取等量的二氧化硫耗酸更少;
(3)NO3-也有强氧化性,也可氧化SO2;
故答案为:NO3-;
(4)①比较不同离子的氧化性,确保离子浓度相同,则加入0.1mol/LNaNO3溶液于试管中;
故答案为:0.1;
②氢离子浓度能影响物质的氧化性,则先测0.1mol/L FeCl3溶液的pH,再用盐酸调节0.3mol/L NaNO3溶液的pH与其相同;
故答案为:先测0.1mol/L FeCl3溶液的pH,再用盐酸调节0.3mol/L NaNO3溶液的pH与其相同;
③同时滴加等量的溶有二氧化硫的品红溶液;
故答案为:向A、B试管中滴加等量的溶有二氧化硫的品红溶液;
预期现象和结论:若A试管溶液先变红,则是Fe3+最先氧化SO2;若B试管溶液先变红,则是NO3-最先氧化SO2;
故答案为:若A试管溶液先变红,则是Fe3+最先氧化SO2;若B试管溶液先变红,则是NO3-最先氧化SO2;
(5)NO3-在酸性条件下的氧化性强于Fe3+,Fe2+与NO3-在酸性溶液中不能大量共存,该观点正确,NO3-的强氧化性与溶液的酸碱性强弱有关;
故答案为:正确;与溶液的酸碱性强弱有关.
点评:本题考查了物质的制备方法以及产物性质的实验设计和现象分析判断,题干信息的分析理解是解题关键,注意掌握物质性质和实验基本操作,题目难度中等.

练习册系列答案
相关题目
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )


| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |
实验室制取下列气体时,必须用排水法收集的是( )
| A、NO |
| B、SO2 |
| C、NH3 |
| D、Cl2 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、溶液中一定不含Cu2+ |
| D、剩余固体中一定含Cu |




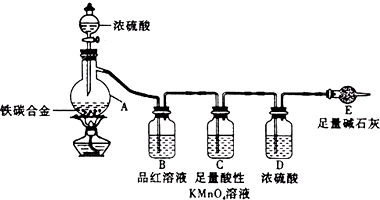 某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质
某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质