题目内容
11.用惰性电极电解100mL AgNO3溶液,当阳极上产生的气体在标准状况下为56mL时(设电解时,阴极无氢气析出,电解液的体积在电解前后基本不变)此时溶液的pH为( )| A. | 1 | B. | 13 | C. | 7 | D. | 1.6 |
分析 用惰性电极电解100mL AgNO3溶液,阳极上OH-放电生成O2,则n(O2)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,
阳极反应式为2H2O-4e-=O2↑+4H+,根据电极反应式知n(H+)=4n(O2)=4×0.0025mol=0.01mol,
c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,根据pH=-lg c(H+)计算溶液pH.
解答 解:用惰性电极电解100mL AgNO3溶液,阳极上OH-放电生成O2,则n(O2)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,
阳极反应式为2H2O-4e-=O2↑+4H+,根据电极反应式知n(H+)=4n(O2)=4×0.0025mol=0.01mol,
c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,根据pH=-lg c(H+)=-lg0.1=1,故选A.
点评 本题以电解原理为载体考查pH计算,为高频考点,明确各个电极反应及氢离子和氧气关系式是解本题关键,侧重考查学生分析计算能力,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
2.不能由铁与非金属单质直接化合而成的物质是( )
| A. | Fe304 | B. | FeCl3 | C. | FeCl2 | D. | FeS |
19.下列化学用语表示正确的是( )
| A. | 甲基的电子式: | B. | 乙炔的最简式:C2H2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 苯分子的比例模型: |
6.下列物质中属于强电解质且能导电的是( )
| A. | NaOH溶液 | B. | Cu | C. | 冰醋酸 | D. | 熔化的KOH |
16.下列化学反应的离子方程式错误的是( )
| A. | Al(OH)3与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | Al2O3溶于过量NaOH溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 铁溶于稀H2SO4中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Al(OH)3溶于NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O |
20.氯碱工业电解所用的氯化钠溶液需精制.除去有影响的Ca2+,Mg2+,NH4+,SO42-及泥沙,其精制流程如下:
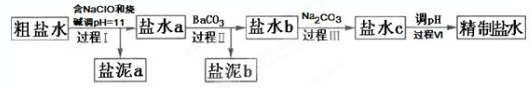
已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9.
下列说法正确的是( )

已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
下列说法正确的是( )
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
1.下列说法正确的是( )
| A. | 按系统命名法,CH3CH(C2H5)CH(C2H5)CH3的名称是2,3-二乙基丁烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 通过石油裂解可以得到乙烯、丙烯、甲烷、苯、甲苯等重要化工基本原料 | |
| D. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 |
