题目内容
1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和浓盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应产物的性质.甲、乙同学采用的装置如下图所示,回答下列问题:
(1)写出实验中制备氯气的化学方程式 .
(2)对于乙同学的实验装置,要停止实验,其操作顺序是 .
①停止加热 ②取出集气瓶盖好 ③将导管加装防倒吸装置后伸入到烧碱溶液中
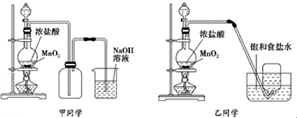
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做了以下两个实验.实验操作、现象、结论记录如下:
请你填写下表,评价甲、乙同学实验①、②的结论(填合理或不合理):
若不合理,理由是
(4)实验中甲、乙两同学均发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,甲、乙两同学对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体混合,加热
①实验b的目的是 ;实验c的目的是 .
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是 .
(1)写出实验中制备氯气的化学方程式
(2)对于乙同学的实验装置,要停止实验,其操作顺序是
①停止加热 ②取出集气瓶盖好 ③将导管加装防倒吸装置后伸入到烧碱溶液中

(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做了以下两个实验.实验操作、现象、结论记录如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
| 实验序号 | 甲 | 乙 |
| ① | ||
| ② |
(4)实验中甲、乙两同学均发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,甲、乙两同学对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体混合,加热
①实验b的目的是
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是
考点:氯气的实验室制法,氯、溴、碘的性质实验
专题:实验题
分析:(1)盐酸二氧化锰在加热条件下反应生成氯气、氯化锰和水;
(2)按照实验操作安全及尾气处理要求:乙同学停止实验应先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
(4)①氯化钠固体电离产生氯离子,加入氯化钠固体,改变氯离子浓度;硫酸电离产生大量氢离子,加入浓硫酸实际改变氢离子浓度;
②依据实验现象分析实验结论.
(2)按照实验操作安全及尾气处理要求:乙同学停止实验应先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
(4)①氯化钠固体电离产生氯离子,加入氯化钠固体,改变氯离子浓度;硫酸电离产生大量氢离子,加入浓硫酸实际改变氢离子浓度;
②依据实验现象分析实验结论.
解答:
解:(1)实验室制备氯气的方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)氯气有毒不能排放到空气中,先停止加热容易发生倒吸,所以乙同学的实验装置,要停止实验,其操作顺序为:先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
故答案为:②③①;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
故答案为:
因为甲同学收集的氯气中含有大量的氯化氢杂质,溶于水时也会与碳酸氢钠粉末反应而产生气泡;
(4)①b加入氯化钠固体,改变氯离子浓度;c加入浓硫酸,改变的是氢离子的浓度;
故答案为:探究氯离子浓度对反应的影响;探究氢离子浓度对反应的影响;
②a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成,由此得出影响氯气生成与氢离子浓度大小有关,故答案为:氢离子浓度大小.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)氯气有毒不能排放到空气中,先停止加热容易发生倒吸,所以乙同学的实验装置,要停止实验,其操作顺序为:先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
故答案为:②③①;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
故答案为:
| 实验序号 | 甲 | 乙 |
| ① | 合理 | 合理 |
| ② | 不合理 | 合理 |
(4)①b加入氯化钠固体,改变氯离子浓度;c加入浓硫酸,改变的是氢离子的浓度;
故答案为:探究氯离子浓度对反应的影响;探究氢离子浓度对反应的影响;
②a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成,由此得出影响氯气生成与氢离子浓度大小有关,故答案为:氢离子浓度大小.
点评:本题为实验评价,题目难度中等,明确反应的原理,实验设计的目的是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、金属与盐溶液间的反应一定是置换反应 | ||||
| B、能与酸反应的氧化物一定是碱性氧化物 | ||||
C、
| ||||
| D、常见金属铁和铝在工业上是由热还原法制得的 |
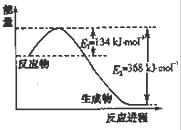
 生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)?CO(g)+3H2(g),试回答下列问题.
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)?CO(g)+3H2(g),试回答下列问题.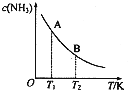 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: