题目内容
下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
| B | 用Cu电极电解NaCl溶液阳极的电极反应式: 2Cl--2e-═Cl2↑ | 正确; Cl-优先于OH-放电 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-═HClO+HSO3- | 正确; H2SO3的酸性强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | 正确; Mg(OH)2比MgCO3更难溶 |
| A、A | B、B | C、C | D、D |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氯气过量,但是离子方程式中碘离子的系数错误;
B.电解为铜,则阳极金属铜放电,氯离子不放电;
C.次氯酸能够氧化亚硫酸氢根离子;
D.氢氧化钠过量,氢氧化镁比碳酸镁更难溶,反应生成氢氧化镁沉淀.
B.电解为铜,则阳极金属铜放电,氯离子不放电;
C.次氯酸能够氧化亚硫酸氢根离子;
D.氢氧化钠过量,氢氧化镁比碳酸镁更难溶,反应生成氢氧化镁沉淀.
解答:
解:A.Fe2+的还原性比I-强,1mol FeI2完全氧化消耗1.5 mol Cl2,则氯气过量,反应的离子方程式为:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2,离子方程式及评价都不合理,故A错误;
B.用Cu电极电解NaCl溶液,阳极铜放电,电极反应式为:Cu-2e-=Cu2+,离子方程式的书写及评价均不合理,故B错误;
C.HClO有强氧化性,能够氧化SO2,正确的离子方程式为:SO2+H2O+ClO-=Cl-+SO42-+2H+,评价及离子方程式均不合理,故C错误;
D.Mg(HCO3)2溶液与足量的NaOH溶液,反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,离子方程式和平均都正确,故D正确;
故选D.
B.用Cu电极电解NaCl溶液,阳极铜放电,电极反应式为:Cu-2e-=Cu2+,离子方程式的书写及评价均不合理,故B错误;
C.HClO有强氧化性,能够氧化SO2,正确的离子方程式为:SO2+H2O+ClO-=Cl-+SO42-+2H+,评价及离子方程式均不合理,故C错误;
D.Mg(HCO3)2溶液与足量的NaOH溶液,反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,离子方程式和平均都正确,故D正确;
故选D.
点评:本题考查了离子方程式的书写及判断,题目难度中等,注意掌握离子方程式的书写原则,本题中既要判断离子方程式是否正确,还要判断题中评价是否合理.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于金属铝及其化合物的叙述,正确的是( )
| A、铝是地壳中含量最多的元素 |
| B、铝在常温下不能与氧气反应 |
| C、氧化铝熔点很高,是一种很好的耐火材料 |
| D、氢氧化铝碱性很强,可用于治疗胃酸过多 |
据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH?CH3CHO;已知△H<0.据此你认为下列说法中错误的是( )
| A、该星球表面温度很高 |
| B、该星球表面温度很低 |
| C、该反应为放热反应 |
| D、高温下稳定性CH2=CHOH>CH3CHO |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,1 mol CO2和CO的混合气中含有的氧原子数为1.5NA |
| B、常温常压下,33.6 L 氯化氢气体中含有的分子数为1.5NA |
| C、12g Mg与足量二氧化碳反应转移的电子数为NA |
| D、1 mol?L-1 CuCl2溶液中含有的氯离子数为2NA |
设NA为阿伏加德常数的值,下列说法正确的是( )
| A、32gSO2含有2NA个S=O键 |
| B、0.3 mol NO2与足量水充分反应转移的电子数目为0.2NA |
| C、1 mol碳的同位素中含有6NA个中子 |
| D、25 mL 16.0 mol?L-l浓盐酸与足量MnO2,加热反应,生成Cl2分子数目为0.1NA |
下列过程没有发生化学反应的是( )
| A、用活性炭去除冰箱中的异味 |
| B、用热碱水清除炊具上残留的油渍 |
| C、用浸泡过高锰酸钾溶液的砖头储存水果 |
| D、用含硅胶、铁粉的透气小袋与食品一起密封包装 |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-) |
| C、常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol?L-1 |
| D、物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
下列氧化物的稳定性前者比后者强的是( )
| A、CO和CO2 |
| B、GeO和GeO2 |
| C、SnO和SnO 2 |
| D、PbO和PbO2 |
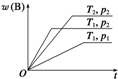 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |