题目内容
设NA为阿伏加德常数的值,下列说法正确的是( )
| A、32gSO2含有2NA个S=O键 |
| B、0.3 mol NO2与足量水充分反应转移的电子数目为0.2NA |
| C、1 mol碳的同位素中含有6NA个中子 |
| D、25 mL 16.0 mol?L-l浓盐酸与足量MnO2,加热反应,生成Cl2分子数目为0.1NA |
考点:阿伏加德罗常数
专题:
分析:A、1mol二氧化硫中含2molS=O键;
B、NO2与水的反应是歧化反应;
C、碳的同位素有12C和14C;
D、MnO2只能与浓盐酸反应.
B、NO2与水的反应是歧化反应;
C、碳的同位素有12C和14C;
D、MnO2只能与浓盐酸反应.
解答:
解:A、32g SO2的物质的量为0.5mol,每个SO2中含有2个S=O键,故32g SO2含有NA个S=O键,故A错误;
B、NO2与水的反应是歧化反应,3molNO2转移2mol电子,故0.3molNO2转移0.2mol电子,故B正确;
C、碳的同位素有12C和14C,故1mol碳的同位素中可能含6NA或8NA个中子,故C错误;
D、MnO2只能与浓盐酸反应,随着反应的进行,浓盐酸的浓度降低,变为稀盐酸反应即停止,故生成的Cl2少于0.1mol,故D错误.
故选B.
B、NO2与水的反应是歧化反应,3molNO2转移2mol电子,故0.3molNO2转移0.2mol电子,故B正确;
C、碳的同位素有12C和14C,故1mol碳的同位素中可能含6NA或8NA个中子,故C错误;
D、MnO2只能与浓盐酸反应,随着反应的进行,浓盐酸的浓度降低,变为稀盐酸反应即停止,故生成的Cl2少于0.1mol,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
下列说法正确的是( )
| A、KCl和SO3溶于水后都能导电,故KCl和SO3均为电解质 |
| B、相同浓度和体积的强酸与强碱溶液混合后,溶液的pH=7 |
| C、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D、AgCl易转化为AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp(AgCl) |
下列离子方程式书写错误的是( )
| A、氯气通入KI溶液中:Cl2+2I-═2Cl-+I2 |
| B、氯气溶于水中:Cl2+H2O═H++Cl-+HClO |
| C、碳酸氢钠溶液与硝酸反应:HCO3-+H+═H2O+CO2↑ |
| D、氯化铁溶液中加入过量氨水:Fe3++3OH-═Fe(OH)3↓ |
将某金属0.1mol与氯气充分反应后,生成物的质量比原金属的质量增加了7.1g,这种金属可能是( )
| A、K | B、Cu | C、Na | D、Al |
下列化学用语正确的是( )
A、CO2分子的比例模型: |
B、NH4Br的电子式: |
C、基态Fe原子的原子结构示意图: |
D、基态Al原子的价电子排布图: |
已知:C (s)+O2(g)=CO(g)△H=-110.50KJ/mol
C (s)+O2(g)=CO2(g)△H=-393.51KJ/mol
则反应C (s)+CO2(g)=2CO(g)的△H为( )
C (s)+O2(g)=CO2(g)△H=-393.51KJ/mol
则反应C (s)+CO2(g)=2CO(g)的△H为( )
| A、-283.01KJ/mol |
| B、+172.51 KJ/mol |
| C、+283.01KJ/mol |
| D、-504.01 KJ/mol |
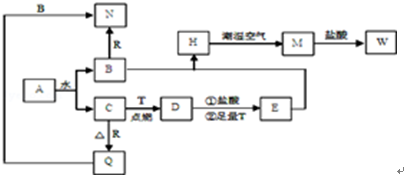
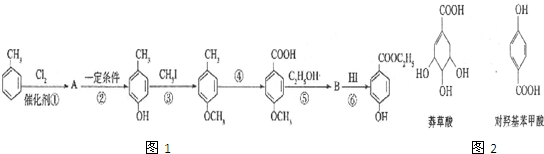
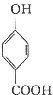 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式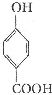 所有同分异构体的结构简式
所有同分异构体的结构简式