题目内容
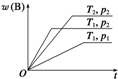 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据温度、压强对平衡移动的影响分析,温度越高、压强越大,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大.
解答:
解:相同压强下,根据温度对反应速率的影响可知,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:T1>T2,升高温度,B的含量减小,平衡向正反应方向移动,则正反应为吸热反应;
相同温度下,根据压强对反应速率的影响可知,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P2>P1,压强越大,B的含量越大,说明平衡向逆反应方向移动,则a+b<c,故选B.
相同温度下,根据压强对反应速率的影响可知,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P2>P1,压强越大,B的含量越大,说明平衡向逆反应方向移动,则a+b<c,故选B.
点评:本题考查了温度、压强对化学平衡的影响,根据“先拐先平数值大”确定温度、压强的相对大小,再结合温度、压强与生成物D物质的量的变化确定反应热及气体的计量数变化,难度中等.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
含有较多Ca2+、Mg2+和HCO
的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水.现有一锅炉厂使用这种水,试判断其水垢的主要成分为( ) (已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=5.6×10-12)
- 3 |
| A、CaO、MgO |
| B、CaCO3、MgCO3 |
| C、CaCO3、Mg(OH)2 |
| D、CaCO3、MgO |
 A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )| A、若X为Cl2,则C可能为FeCl3 |
| B、若X为KOH溶液,则A可能为AlCl3 |
| C、若X为O2,则A一定为硫化氢 |
| D、若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 |
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是( )
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |

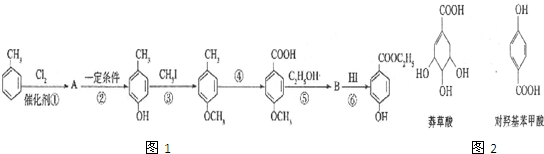
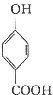 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式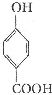 所有同分异构体的结构简式
所有同分异构体的结构简式