题目内容
14.SO2是大气污染物之一,某同学在实验室中对SO2与氯水的反应进行了探究. 制备SO2与氯水可供选择的仪器如图所示,请回答下列问题: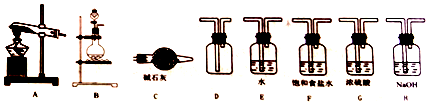
(1)该同学选用KMnO4和浓盐酸快速制备Cl2,该反应的离子方程式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
预制备一瓶饱和氯水,请选择上图中的装罝,其连接顺序为:BEH或BEC(按气流方向,用字母衣示).
(2)制备SO2的适宜药品为①④ (填代号).
①Na2SO3固体②Na2SO3溶液③20%硫酸④70%硫酸⑤铜片
(3)对SO2与氯水的反应进行探究
①用注射器吸入一定量的饱和氯水和SO2,震荡,静置,再吸入少量品红溶液,发现品红溶液不褪色,解释其原因(用化学反应方程式表示)Cl2+SO2+2H2O=2HCl+H2SO4.
②改变氯水用量,重复①操作,发现品红溶液红色褪色,你认为可能的原因是过量氯水将品红氧化漂白或过量SO2与品红结合成无色物质.
设计一个实验(说明操作方法、现象及结论)来验证你的假设:将实验②注射器中的溶液注入试管少许,加热,若无红色出现,原因为前者,反之则为后者.
(4)请你设计一个实验,测定饱和氯水中氯元素的含量:量取一定量的试样,加入足量的Fe(NO3)2溶液,再加入足量的硝酸银溶液,过滤、洗涤,干燥,称量沉淀质量.
分析 (1)高锰酸钾与浓盐酸反应生成氯气、氯化锰、氯化钾和水,依据反应物状态和条件选择发生装置,氯气污染环境,需要吸收;
(2)制备SO2的适宜药品为亚硫酸钠和浓硫酸;
(3)①饱和氯水和SO2反应刚好生成盐酸和硫酸时,不具有漂白性;
②当氯气或者二氧化硫多余时,溶液具有漂白性;二氧化硫的漂白具有加热可恢复性,据此分析;
(4)利用氧化还原反应生成氯离子,利用硝酸银检验氯离子.
解答 解:(1)用KMnO4和浓盐酸快速制备Cl2,离子方程式为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,反应为固液不加热型,选择B装置制备氯气,氯气与水获得氯水,最后选择碱石灰或者氢氧化钠吸收多余的氯气,故连接顺序为BEH或BEC;
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;BEH或BEC;
(2)制备SO2的适宜药品为亚硫酸钠和浓硫酸;
故答案为:①④;
(3)①饱和氯水和SO2反应刚好生成盐酸和硫酸时,不具有漂白性,故反应为:Cl2+SO2+2H2O=2HCl+H2SO4;
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;
②当氯气或者二氧化硫多余时,过量氯水将品红氧化漂白或过量SO2与品红结合成无色物质;因为二氧化硫的漂白具有加热可恢复性,故将实验②注射器中的溶液注入试管少许,加热,若无红色出现,原因为前者,反之则为后者;
故答案为:过量氯水将品红氧化漂白或过量SO2与品红结合成无色物质;将实验②注射器中的溶液注入试管少许,加热,若无红色出现,原因为前者,反之则为后者;
(4)测定饱和氯水中氯元素的含量,用Fe(NO3)2将所有的氯元素反应为氯离子,再利用硝酸银检验氯离子,方法为:量取一定量的试样,加入足量的Fe(NO3)2溶液,再加入足量的硝酸银溶液,过滤、洗涤,干燥,称量沉淀质量;
故答案为:量取一定量的试样,加入足量的Fe(NO3)2溶液,再加入足量的硝酸银溶液,过滤、洗涤,干燥,称量沉淀质量.
点评 本题考查了气体的制备和性质的检验,明确氯气、二氧化硫的制备原理及制备气体的一般程序和性质解题关键,题目难度中等,侧重于考查学生的分析能力和实验探究能力.

 名校课堂系列答案
名校课堂系列答案| A. | 用FeCl3对饮用水进行杀菌、消毒 | |
| B. | 用电解氯化铝溶液的方法制取铝单质 | |
| C. | NH4F溶液储存于玻璃试剂瓶中 | |
| D. | 加热并蒸干硫酸铜溶液可得到硫酸铜固体 |
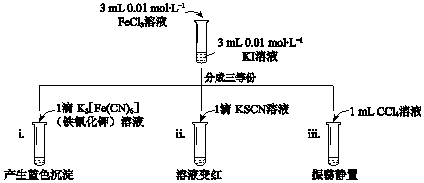
| A. | 实验i中现象说明有Fe2+生成 | |
| B. | 实验ii中现象说明反应后溶液中含有Fe3+ | |
| C. | 实验iii水溶液中c(Fe2+)大于i中c(Fe2+) | |
| D. | 实验iii中再加入4滴0.1 mol•L-1 FeCl2溶液,振荡静置,CCl4层溶液颜色无变化 |
| A. | H、D、T互为同素异形体 | |
| B. | H2O2分子中含有非极性键和极性共价键 | |
| C. | NH4Cl的电子式为: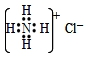 | |
| D. | CO2分子的比例模型图: |
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 工业上用Y和Z组成的化合物冶炼Z的单质 | |
| C. | X、Y形成的化合物一定为酸性氧化物 | |
| D. | W的单质和氧化物均可与NaOH溶液反应 |
| A. | 200g 63%的浓硝酸中含氧原子的数目为6NA | |
| B. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,乙稀与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间的共用电子对数目为NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
