题目内容
6.0.1mol•L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )①电离程度增大 ②c(NH3•H2O)增大 ③NH4+数目增多 ④c(OH-)增大 ⑤导电性增强.
| A. | ①②③ | B. | ①③⑤ | C. | ①③ | D. | ②④ |
分析 ①加水促进电离;
②加水时电离平衡正向移动,n(NH3•H2O)减小;
③加水时电离平衡正向移动,n(NH4+)增大;
④加水时电离平衡正向移动,n(OH-)增大;
⑤离子的浓度越大,导电性越强.
解答 解:①因加水促进弱电解质的电离,则氨水的电离程度增大,故①正确;
②加水时电离平衡正向移动,n(NH3•H2O)减小,且溶液的体积变大,则c(NH3•H2O)减小,故②错误;
③加水时电离平衡正向移动,n(NH4+)增大,由N=n×NA,则NH4+数目增多,故③正确;
④加水时电离平衡正向移动,n(OH-)增大,但溶液的体积变大,则c(OH-)减小,故④错误;
⑤加水稀释时,溶液中的离子的浓度减小,则导电性减弱,故⑤错误;
故选C.
点评 本题考查加水对氨水电离平衡的影响,明确离子的物质的量的变化与浓度的变化的区别是解答的关键,并注意稀释时溶液的体积增大来分析解答,题目难度中等.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
16.下列叙述正确的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量转化的途径不同时,体系包含的总能量不同 | |
| C. | 放热反应指生成物的总能量高于反应物的总能量 | |
| D. | 吸热反应不加热就不会发生 |
1.下列说法中不正确的是( )
| A. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 硅胶可做袋装食品的干燥剂 | |
| D. | 晶体硅可用于制作半导体材料与其熔点高硬度大无关 |
11.下列说法正确的是( )
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 升高温度或使用催化剂是通过增加活化分子百分数而使反应速率加快 | |
| C. | 勒夏特列原理只使用于可逆反应,不使用于溶解和弱电解质的电离 | |
| D. | △G=△H-T△S适合任意条件的化学反应进行的方向判据 |
18.下列应用或事实与胶体的性质没有关系的是( )
| A. | 在河流入海口处易形成三角州 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 用石膏或盐卤点制豆腐 |
10.室温下,0.l 000mol/L NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如图1.其中①点所示溶液中c(CH3COO-)=2c(CH3COOH),③点溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+).
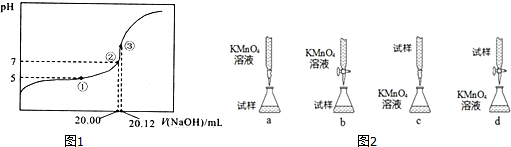
(1)滴定应该选用酚酞做指示剂
(2)该温度下CH3COOH的电离常数Ka=2×10-5,
(3)醋酸的实际浓度为0.1006mol/L(保留四位有效数字)
(4)下列情况可能引起测定结果偏高的是AC.
A、碱式滴定管未用标准溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定、氧化还原滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的D.
A.KBr B.KI C.K2S D.K2CrO4
(6)在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是:Fe2++MnO4-+H+--Fe3++Mn2++H2O(未配平)图2四种滴定方式(夹持部分略去),你认为最合理的是b(填字母序号).判断滴定终点的依据滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色.

(1)滴定应该选用酚酞做指示剂
(2)该温度下CH3COOH的电离常数Ka=2×10-5,
(3)醋酸的实际浓度为0.1006mol/L(保留四位有效数字)
(4)下列情况可能引起测定结果偏高的是AC.
A、碱式滴定管未用标准溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定、氧化还原滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4
(6)在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是:Fe2++MnO4-+H+--Fe3++Mn2++H2O(未配平)图2四种滴定方式(夹持部分略去),你认为最合理的是b(填字母序号).判断滴定终点的依据滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色.