题目内容
5.20℃时,将16.00g NaOH溶于24.0g H2O中,得到密度为1.43g/cm3的烧碱溶液.试计算:(1)此溶液中NaOH的质量分数
(2)此溶液中NaOH的物质的量浓度.
分析 (1)溶液中NaOH的质量分数=$\frac{溶质的质量}{溶液的质量}$×100%=$\frac{溶质的质量}{溶质的质量+溶剂的质量}$×100%;
(2)该溶液体积=$\frac{16.00g+24.00g}{1.43g/mL}$,n(NaOH)=$\frac{16.00g}{40g/mol}$=0.4mol,根据c=$\frac{n}{V}$计算物质的量浓度.
解答 解:(1)溶液中NaOH的质量分数=$\frac{溶质的质量}{溶液的质量}$×100%=$\frac{溶质的质量}{溶质的质量+溶剂的质量}$×100%=$\frac{16.00g}{16.00g+24.0g}$×100%=40%,
答:溶液中NaOH的质量分数为40%;
(2)该溶液体积=$\frac{16.00g+24.00g}{1.43g/mL}$=$\frac{40}{1.43}$mL,n(NaOH)=$\frac{16.00g}{40g/mol}$=0.4mol,c(NaOH)=$\frac{n}{V}$=$\frac{0.4mol}{(\frac{40}{1.43})×1{0}^{-3}L}$=14.3mol/L,
答:溶液中NaOH的物质的量浓度是 14.3mol/L.
点评 本题考查物质的量浓度的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意mL与L之间的单位换算,题目难度不大.

练习册系列答案
相关题目
15.亚硫酸钠和硫粉通过化合反应可制得硫代硫酸钠(Na2S2O3).
已知:Na2S2O3在酸性溶液中不能稳定存在.有关物质的溶解度随温度变化曲线如图2所示.某研究小组设计了制备Na2S2O3•5H2O的装置图(如图1).
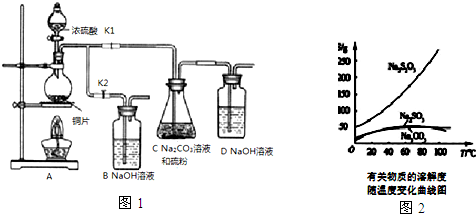
部分操作步骤如下:
①打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时,即停止C中的反应,停止加热
③过滤C中的混合液,并将滤液进行处理,得到产品.
(1)步骤①中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)步骤②中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
(3)步骤③中,“过滤”用到的玻璃仪器是烧杯、漏斗、玻璃棒(填仪器名称).将滤液进行处理过程是将滤液经过加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
依据反应2S2O32-+I2→S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
(4)判断达到滴定终点的现象是加入最后一滴I2标准溶液后,溶液变蓝,且半分钟不改变.
(5)Na2S2O3•5H2O在产品中的质量分数是90.2%.(计算结果请用百分数表示并保留1位小数)(Na2S2O3•5H2O的式量为248)
已知:Na2S2O3在酸性溶液中不能稳定存在.有关物质的溶解度随温度变化曲线如图2所示.某研究小组设计了制备Na2S2O3•5H2O的装置图(如图1).

部分操作步骤如下:
①打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时,即停止C中的反应,停止加热
③过滤C中的混合液,并将滤液进行处理,得到产品.
(1)步骤①中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)步骤②中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
(3)步骤③中,“过滤”用到的玻璃仪器是烧杯、漏斗、玻璃棒(填仪器名称).将滤液进行处理过程是将滤液经过加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
依据反应2S2O32-+I2→S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
(5)Na2S2O3•5H2O在产品中的质量分数是90.2%.(计算结果请用百分数表示并保留1位小数)(Na2S2O3•5H2O的式量为248)
16.下列叙述正确的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量转化的途径不同时,体系包含的总能量不同 | |
| C. | 放热反应指生成物的总能量高于反应物的总能量 | |
| D. | 吸热反应不加热就不会发生 |
13.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如表:
(1)放置时,雨水样品pH变化的主要原因酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强.
(2)pH变化的离子方程式:2H2SO3+O2=4H++SO42-.
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(2)pH变化的离子方程式:2H2SO3+O2=4H++SO42-.
20.用氯气消毒的自来水配制下列溶液时,会使配制的溶液变质的是( )
①NaOH②AgNO3③Na2CO3④FeCl2.
①NaOH②AgNO3③Na2CO3④FeCl2.
| A. | 只有②④ | B. | 只有④ | C. | 只有② | D. | 全部 |