题目内容
6.运用所学知识回答下列问题.(1)0.5mol CH4中含有0.5NA个甲烷分子(阿伏加德罗常数用NA表示),在标准状况下的体积为11.2L.0.1molH2SO4中含0.2molH原子,溶于水配成100mL水溶液后后C(H+)=2mol/L.
(2)在反应3Zn+2Fe3+═3Zn2++2Fe中,Fe3+是氧化(填“氧化”或“还原”)剂,1molZn完全反应转移的电子数为2mol.
(3)选择下列实验方法分离物质,将分离方法的序号填在横线上(单选).
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
①分离粗盐中混有的泥沙F.②分离碘和水的混合物A.
③分离水和汽油的混合物D.④分离酒精和水的混合物E.
(4)有下列三组物质①CaO、SO3、SO2、P2O5 ②HNO3、H2SO4、HCl、NaCl③KClO3、KCl、KMnO4、HgO各组中均有一种物质所属类别与其他物质不同,这三种物质分别是:①CaO;②NaCl;③HgO.
分析 (1)根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$结合物质的构成以及c=$\frac{n}{V}$计算相关物理量,
(2)在反应3Zn+2Fe3+═3Zn2++2Fe中,Fe元素化合价由+3价降低到0价,Zn元素化合价由0价升高到+2价;
(3)根据混合物中各物质溶解性、沸点、被吸附性能及在不同溶剂中溶解性的不同,可以选用过滤和结晶、蒸馏(或分馏)、纸上层析、萃取和分液等方法进行分离和提纯;
(4)CaO为碱性氧化物,SO3、SO2、P2O5均为酸性氧化物;
②HNO3、H2SO4、HCl均为酸,而NaCl属于盐;
③KClO3、KCl、KMnO4均为盐,而HgO属于氧化物.
解答 解:(1)0.5mol CH4中含有0.5NA个甲烷分子(阿伏加德罗常数用NA表示),在标准状况下的体积为0.5mol×22.4L/mol=11.2L.0.1molH2SO4中含0.2molH原子,溶于水配成100mL水溶液后后C(H+)=$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:0.5NA;11.2L;0.2;2mol/L;
(2)在反应3Zn+2Fe3+═3Zn2++2Fe中,Fe元素化合价由+3价降低到0价,Fe3+为氧化剂,Zn元素化合价由0价升高到+2价,1molZn完全反应转移的电子数为2mol电子,
故答案为:氧化;2;
(3)①NaCl易溶于水,而泥沙不溶,可用过滤的方法分离,故答案为:F;
②碘易溶于苯等有机溶剂,可用萃取的方法分离,故答案为:A;
③水和汽油互不相溶,二用分液的方法分离,故答案为:D;
④酒精和水互溶,可用蒸馏的方法分离,蒸馏时在混合液中加入CaO或碱石灰,然后整列可将二者分离,故答案为:E;
(4)①CaO为碱性氧化物,SO3、SO2、P2O5均为酸性氧化物;
②HNO3、H2SO4、HCl均为酸,而NaCl属于盐;
③KClO3、KCl、KMnO4均为盐,而HgO属于氧化物,
故答案为:CaO;NaCl;HgO.
点评 本题考查较为综合,涉及物质的量的计算、氧化还原反应、物质的分离、提纯以及物质的分类,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意把握物质的性质以及相关计算公式的运用,难度不大.

 CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )
CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )| A. | (1)NaOH (2)浓H2SO4 | B. | (1)浓H2SO4 (2)NaOH | ||
| C. | (1)饱和NaHCO3 (2)浓H2SO4 | D. | (1)浓H2SO4 (2)Na2CO3 |
| A. | 加热分解NH4Cl固体可以制得NH3 | |
| B. | Fe2O3是碱性氧化物,常用作红色油漆和涂料 | |
| C. | 硅单质常用来制作光导纤维和太阳能电池 | |
| D. | 浓硫酸具有脱水性,可以干燥Cl2 |
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等物质的量的二氧化硫和一氧化碳所含的分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
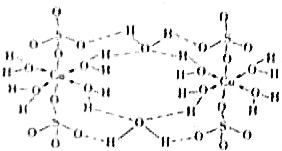 下列说法正确的是( )
下列说法正确的是( )| A. | 在如图结构示意图中,所有氧原子都采用sp3杂化 | |
| B. | 在如图结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
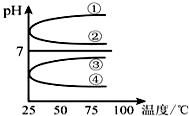 (1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).
(1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号). 和
和  D、35Cl和37Cl
D、35Cl和37Cl