题目内容
11.下列有关实验装置或实验操作正确的是( )| A. | 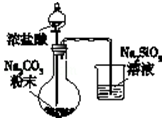 验证酸性:H2CO3>H2SiO3 | |
| B. | 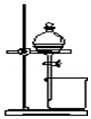 用于分离CCl4萃取碘水后的有机层和水层 | |
| C. | 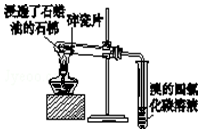 证明石蜡油分解生成的气体是乙烯 | |
| D. | 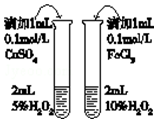 比较不同催化剂对反应速率的影响 |
分析 A.浓盐酸易挥发,盐酸与硅酸钠反应;
B.CCl4萃取碘水后分层;
C.碎瓷片作催化剂,应加热碎瓷片;
D.浓度、催化剂均不同.
解答 解:A.浓盐酸易挥发,盐酸与硅酸钠反应,则不能比较碳酸、硅酸的酸性,故A错误;
B.CCl4萃取碘水后分层,则图中分液装置可分离,故B正确;
C.碎瓷片作催化剂,图中加热的位置不合理,故C错误;
D.浓度、催化剂均不同,由控制变量法可知,应控制浓度相同,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握酸性比较、混合物分离提纯、影响反应速率因素、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
相关题目
1.下列物质间的转化不能一步实现的是( )
| A. | SiO2→H2SiO3 | B. | Na2SiO3→H2SiO3 | C. | NO→NO2 | D. | NH3→NO |
16.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)?2C(g),2s时测得C的浓度为0.6mol•L-1.下列说法正确的是( )
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
3.下列反应的离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀盐酸滴在大理石上:CO32-+2H+═CO2↑+H2O |
20.下列鉴别或者除杂方法可行的是( )
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
1.下列说法中,正确的是( )
| A. | 水的离子积KW随温度、外加酸(碱)浓度的改变而改变 | |
| B. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| C. | 对已达化学平衡的反应,仅改变浓度,若平衡移动,则平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
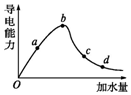 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.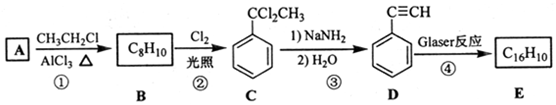
 ,D 的化学名称为苯乙炔.
,D 的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.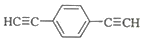 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n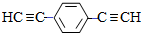 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$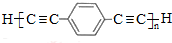 +(n-1)H2.
+(n-1)H2.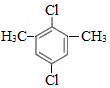 ,
, .
.