题目内容
8.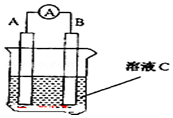 如图原电池装置图:
如图原电池装置图:欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为铜,电解质溶液为氯化铁溶液,10min内该电池向外提供0.1mol电子,负极材料的质量变化为3.2g,假设该电解质溶液为2L,则以Fe3+浓度变化表示的该反应的速率为0.005 mol/(L•min).
分析 根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐溶液为电解质溶液,根据转移电子与Cu的关系式计算消耗Cu的质量;根据转移电子与铁离子的关系计算反应速率.
解答 解:2Fe3++Cu═2Fe2++Cu2+,根据方程式可知,铜的化合价升高,失电子,应作为原电池的负极;3价铁离子化合价降低,得到电子,故电解质溶液可选用氯化铁;正极可选用惰性电极石墨(Pt亦可);又负极反应为Cu-2e-=Cu2+,根据电极反应式可知,消耗1mol铜,转移2mol电子,故转移0.1mol电子,消耗的铜为0.05mol,质量为0.05mol×64g/mol=3.2g,同时消耗Fe3+的物质的量为0.1mol,所以Fe3+浓度变化表示的该反应的速率为:$\frac{\frac{0.1mol}{2L}}{10min}$=0.005 mol/(L•min),
故答案为:铜;氯化铁溶液;3.2g;0.005 mol/(L•min).
点评 本题考查了原电池原理的分析判断,原电池原理和电极分析判断是解题关键,注意电极反应生成的离子在电解质溶液中的存在分析,题目难度中等.

练习册系列答案
相关题目
18.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景.实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
| A. | 2FeCO3(s)+O2(g)=Fe2O3(s)+2CO2(g)△H=-130 KJ/mol | |
| B. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+130 KJ/mol |
16.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)?2C(g),2s时测得C的浓度为0.6mol•L-1.下列说法正确的是( )
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
3.下列反应的离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀盐酸滴在大理石上:CO32-+2H+═CO2↑+H2O |
20.下列鉴别或者除杂方法可行的是( )
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
17.下列关于硅及其化合物的说法不正确的是( )
| A. | SiO2和CO2一样能够与NaOH溶液反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅酸是一种比碳酸还弱的酸 | |
| D. | 硅的化学性质不活泼,常温下不与任何物质反应 |
18.保护环境,实现可持续发展是全人类的共识.下列各项举措中,主要是为了保护大气臭氧层的是( )
| A. | 实现无氰电镀 | B. | 研制可降解塑料 | C. | 使用无铅汽油 | D. | 使用无氟冰箱 |
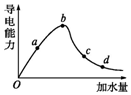 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.