题目内容
1.碳及其化合物在生活、化工领域发挥着重要的作用.试回答下列问题:(1)二甲醚(CH30CH3)是无色气体,可作为一种新型能源.工业上可用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H0
已知:
CO2(g)+3H2(g)?CH3OCH3(g)+H2O(g)△H1=-53.7kJ•mol-1
CH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4kJ•mol-1
①合成二甲醚的△H=-130.8kJ.mol-1
②下列能判断恒温恒容条件下合成二甲醚的反应已达到平衡的依据为bc(填字母).
a.气体密度不变
b.压强不变
c.气体平均相对分子质量不变
d.反应前n(C02)=2mol,n(H2)=6mol,一段时间后测得容器中$\frac{n(C{O}_{2})}{n({H}_{2})}$的比值不变
③上述合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图1所示.T1温度下,将6mol CO2和12mol H2充人2L的恒容密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速v(CH3OCH3)=0.18 mol/(L•min);A、B、C三点对应平衡常数KA、KB.KC之间的大小关系为KA=KC>KB.
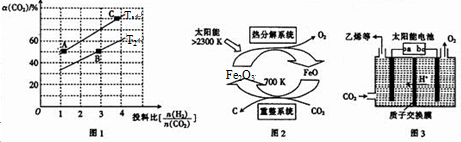
(2)有科学家提出由CO2制取C的太阳能工艺如图2所示,若重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4,则重整系统中发生反应的化学方程式为4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3
(3)以CO2为原料利用电解法可制取乙烯,其装置如图3所示.电极a为电源的负极(填“正极”或“负极”),生成乙烯的电极反应式为2CO2+12e-+12H+=C2H4+4H2O.
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液.反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=1.25×10-3.(已知常温下NH3•H2O的电离平衡常数 Kb=2×l0-5,H2CO3的电离平衡常数K1=4×l0-7)
分析 (1)①已知反应:ⅠCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1 I
ⅡCH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4kJ.mol-1 II
将I×2-II可得合成二甲醚的△H;
②当一个量在反应未平衡的时候一直在变化,而后来不变了,则可以作为平衡的标志;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,根据平均反应速率v(CH3OCH3)=$\frac{△c}{△t}$;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大;
(2)根据由CO2制取C的太阳能工艺图示可知,CO2被FeO还原为C,则FeO将被氧化,根据重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4写出化学方程式;
(3)电极a上通入CO2,生成C2H4,碳元素发生了还原反应,据此分析;根据化合价的变化结合溶液呈酸性来写出电极方程式;
(4)反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})•c(HC{{O}_{3}}^{-})}$,而NH3•H2O的电离平衡常数表达式Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,H2C03的电离平衡常数K1=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,从而可得出平衡常数间的关系,以此解答该题.
解答 解:(1)①已知反应:ⅠCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1 I
ⅡCH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4kJ.mol-1 II
将I×2-II可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)△H=(-53.7kJ.mol-1)×2-(+23.4kJ.mol-1)=-130.8 kJ.mol-1,
故答案为:-130.8 kJ.mol-1;
②对于反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)
a.由于是恒容的容器,容器体积V一直不变,而此反应全部是气体参加和生成,故气体的质量一直不变,则气体的密度无论反应有没有达到平衡都一直不变,故不能作为反应达平衡的标志,故a错误;
b.由于容器恒容,而此反应正反应方向是气体的物质的量减小的反应,故反应在平衡之前,容器内的压强在变小,故当压强不变时,说明反应达平衡,故b正确;
c.此反应全部是气体参加和生成,故气体的质量一直不变,而正反应方向是气体的物质的量减小的反应,故平衡之前,气体平均相对分子质量在变大,故当不变时,能说明反应达平衡,故c正确;
d.反应前n(C02)=2mol,n(H2)=6mol,而根据物质的量的该变量等于计量数之比可知,△(C02):△(H2)=2:6,故无论反应是否达到平衡,n(C02):n(H2)恒等于2:6即1:3,故当比值不变时,不能说明反应达平衡,故d错误;
故答案为:bc;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,所以平均反应速率v(CH3OCH3)=$\frac{\frac{1.8mol}{2L}}{5min}$=0.18 mol/(L•min);
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB;
(2)由CO2制取C的太阳能工艺图示可知,CO2被FeO还原为C,则FeO将被氧化,根据重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4,结合得失电子数守恒和质量守恒可知反应为:4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3,故答案为:4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3;
(3)电极a上通入CO2,生成C2H4,碳元素发生了还原反应,故电极a为阴极,则所连的是电源的负极;此电极上通入CO2,生成C2H4,碳元素的化合价由+4价变为-2价,结合溶液呈酸性可知极方程式为:2CO2+12e-+12H+=C2H4+4H2O,故答案为:负极;2CO2+12e-+12H+=C2H4+4H2O;
(4)反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})•c(HC{{O}_{3}}^{-})}$,而NH3•H2O的电离平衡常数表达式Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,H2C03的电离平衡常数K1=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,从而可得出平衡常数间的关系K=$\frac{Kw}{{K}_{b}•{K}_{1}}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}×4×1{0}^{-7}}$=1.25×10-3,故答案为:1.25×10-3.
点评 本题考查较为综合,涉及盖斯定律的应用、反应达平衡的判断以及平衡常数的有关计算等问题,为高考常见题型,侧重考查学生的分析能力和计算能力,题目综合性较强,注意把握盖斯定律以及平衡常数的运用和计算,难度较大.

①它们所含的分子数目之比为1:1 ②它们所含的O原子数目之比为1:2 ③它们所含的原子数目之比为2:3 ④它们所含的C原子数目之比为1:1 ⑤它们所含的电子数目之比为7:11.
| A. | ①②④ | B. | ①②③ | C. | ①②③⑤ | D. | 全部正确 |
| A. | 离子化合物都能溶于水,而共价化合物都不溶于水 | |
| B. | 离子化合物的熔点一般较高,而共价化合物的熔点一般较低 | |
| C. | 离子化合物的硬度一般较大,而共价化合物的硬度一般较小 | |
| D. | 离子化合物在熔融条件下能够导电,而共价化合物在熔融条件下不能导电 |
| A. | 镁用于制造轻合金,是制造飞机、火箭的重要材料 | |
| B. | 高纯度硅制成的光电池,可用作火星探测器的动力 | |
| C. | 聚脂纤维属于新型无机非金属材料,可制作宇航服 | |
| D. | 高温结构陶瓷耐高温、耐氧化,是喷气发动机的理想材料 |
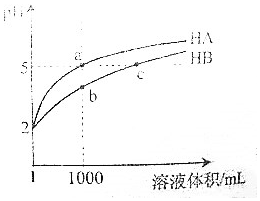 25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )
25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )| A. | Kw的数值:a点大于c点 | |
| B. | 溶液中的总酸量:a点大于b点 | |
| C. | HB的电离程度:b点大于c点 | |
| D. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$减小 |
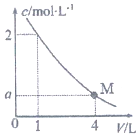 如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )
如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )| A. | 0.25mol/L | B. | 0.5mol/L | C. | 1 mol/L | D. | 2mol/L |
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100ml容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)按实验所得数据,可得c(市售白醋)=0.75mol•L-1;市售白醋总酸量=4.5g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
 在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.
在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.