题目内容
13.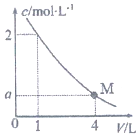 如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )
如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )| A. | 0.25mol/L | B. | 0.5mol/L | C. | 1 mol/L | D. | 2mol/L |
分析 根据稀释定律,稀释前后的物质的量不变,据此计算a的值,结合BaCl2=Ba2++2Cl-,计算氯离子浓度.
解答 解:根据稀释定律,稀释前后的物质的量不变,则:
1L×2mol/L=4L×amol/L,
解得:a=0.5mol/L,
c(Cl-)=2c(Ba2+)=1mol/L,
故选C.
点评 本题以图象形式考查物质的量浓度的有关计算,难度不大,注意基础知识的理解掌握.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
8.一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g)?4C(g),下列叙述能作为该反应达到平衡状 态的标志的是( )
①混合气体平均摩尔质量不再变化
②v(A):v(B):v(C)=1:3:4
③A、B、C 的浓度不再变化
④C 的体积分数不再变化
⑤A、B、C 的分子数之比为 1:3:4
⑥混合气体的密度不再变化
⑦单位时间内消耗 amolA,同时生成 3amolB.
①混合气体平均摩尔质量不再变化
②v(A):v(B):v(C)=1:3:4
③A、B、C 的浓度不再变化
④C 的体积分数不再变化
⑤A、B、C 的分子数之比为 1:3:4
⑥混合气体的密度不再变化
⑦单位时间内消耗 amolA,同时生成 3amolB.
| A. | ③④⑦ | B. | ③④⑤⑥⑦ | C. | ②③④⑦ | D. | ①③⑤⑥⑦ |
5.下列各组溶液,不加其他试剂就能鉴别的是( )
| A. | Na2CO3、H2SO4、HCl、NaNO3 | B. | NaOH、NaCl、K2SO4、FeCl3 | ||
| C. | HCl、AgNO3、HNO3、MgCl2 | D. | K2SO4、Na2CO3、BaCl2、HNO3 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1 NaOH溶液中Na+的数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |