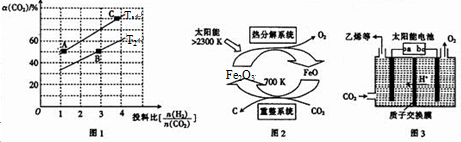
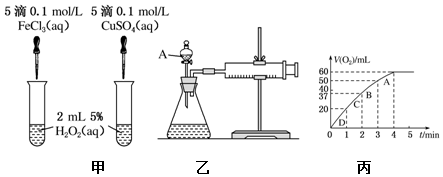
题目内容
6.若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:Ksp[Fe(OH)3]<Ksp[Mg(OH)2],沉淀转化向溶度积更小的方向移动.分析 白色沉淀会全部转化为红褐色沉淀,发生沉淀的转化,因Ksp[Fe(OH)3]<Ksp[Mg(OH)2],以此来解答.
解答 解:向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,从平衡的角度解释沉淀转化的原因为Ksp[Fe(OH)3]<Ksp[Mg(OH)2],沉淀转化向溶度积更小的方向移动,
故答案为:Ksp[Fe(OH)3]<Ksp[Mg(OH)2],沉淀转化向溶度积更小的方向移动.
点评 本题考查难溶电解质及沉淀转化,为高频考点,把握沉淀转化向度积更小的方向移动为解答关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
16.下列离子方程式书写正确的是( )
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ba(OH)2溶液中加入H2SO4溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向Na2CO3溶液中加入少量稀H2SO4溶液:CO32-+2H+═CO2↑+H2O | |
| D. | 过量的铁与稀HNO3反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
15.下列物质中只含离子键的化合物是( )
| A. | NaCl | B. | Fe | C. | HCl | D. | N2 |
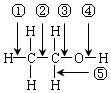 ,乙醇与钠反应时,断开的键是④;与HX反应时,断开的键是③;分子内脱水生成乙烯时,断开的键是①③;分子间脱水生成乙醚时,断开的键是③④;在铜催化作用下发生催化氧化反应时,断开的键是④⑤;酯化反应时,断开的键是④.
,乙醇与钠反应时,断开的键是④;与HX反应时,断开的键是③;分子内脱水生成乙烯时,断开的键是①③;分子间脱水生成乙醚时,断开的键是③④;在铜催化作用下发生催化氧化反应时,断开的键是④⑤;酯化反应时,断开的键是④.