��Ŀ����
9��A��B��C��D��EΪԭ������������������ֶ�����Ԫ�أ�A��Eͬ���壬A����B��C��D�ֱ��γɵ�������ȵ�����10���ӷ��ӣ�C��D����������֮����E�ĺ������������ȣ��Իش���1��BԪ�������ڱ��е�λ��Ϊ�ڶ�����IVA�壬A��C��E����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳����Na��N��H����Ԫ�ط�����д����
��2��������BA4�Ŀռ乹��Ϊ�������壻������E2D2�л�ѧ������Ϊ���Ӽ������ۼ��� ������C2A4��һ�ָ��������ӣ���Cԭ������8�����ȶ��ṹ��д��C2A4�ĵ���ʽ
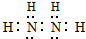 ��
����3��A��D��E����Ԫ�ؿ��γ�һ�����ӻ�����R��A��C��D����Ԫ�ؿ��γ�һ�ֹ��ۻ�����N��NΪǿ����ʣ���0.2mol/L50mLN��0.2mol/L55mLR��ϡ��Һ��ϣ���÷ų�������ΪakJ��д���÷�Ӧ���Ȼ�ѧ����ʽ��NaOH��aq��+HNO3��aq��=NaNO3 ��aq��+H2O��l����H=-100akJ/mol��
��4���������ӷ���ʽ����E2BD3��Һ�ʼ��Ե�ԭ��CO32-+H2O
 HCO3-+OH-�� 0.2mol/L����Һ������Ũ���ɴ�С��˳��Ϊc��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
HCO3-+OH-�� 0.2mol/L����Һ������Ũ���ɴ�С��˳��Ϊc��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
���� A��B��C��D��EΪԭ������������������ֶ�����Ԫ�أ�A��E ͬ���壬���ԭ��������֪��Eֻ�ܴ��ڵ������ڣ�A ����B��C��D�ֱ��γɵ�������ȵ�����10���ӷ��ӣ�����Ϊ�⻯�AΪHԪ�أ���EΪNaԪ�أ�C��D����������֮����E�ĺ������������ȣ����B��ԭ������С��C����֪C��D�����������ֱ�Ϊ5��6����BΪ̼Ԫ�ء�CΪNԪ�ء�DΪOԪ�أ��������⣬�ݴ˽��
��� �⣺A��B��C��D��EΪԭ������������������ֶ�����Ԫ�أ�A��E ͬ���壬���ԭ��������֪��Eֻ�ܴ��ڵ������ڣ�A ����B��C��D�ֱ��γɵ�������ȵ�����10���ӷ��ӣ�����Ϊ�⻯�AΪHԪ�أ���EΪNaԪ�أ�C��D����������֮����E�ĺ������������ȣ����B��ԭ������С��C����֪C��D�����������ֱ�Ϊ5��6����BΪ̼Ԫ�ء�CΪNԪ�ء�DΪOԪ�أ��������⣮
��1��BΪ̼Ԫ�أ������ڱ��е�λ��Ϊ�ڶ�����IVA�壬
ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶Na��N��Hԭ�Ӱ뾶��С����ԭ�Ӱ뾶Na��N��H��
�ʴ�Ϊ���ڶ�����IVA�壻Na��N��H��
��2��������CH4�Ŀռ乹��Ϊ�������壬������Na2O2�л�ѧ������Ϊ���Ӽ������ۼ���������N2H2��һ�ָ��������ӣ���Nԭ������8�����ȶ��ṹ��Nԭ��֮���γ�2�Թ��õ��Ӷԡ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ��������ʽΪ��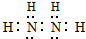 ��
��
�ʴ�Ϊ���������壻���Ӽ������ۼ���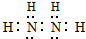 ��
��
��3��H��O��Na����Ԫ�ؿ��γ�һ�����ӻ�����RΪNaOH��H��N��O����Ԫ�ؿ��γ�һ�ֹ��ۻ�����NΪǿ����ʣ���NΪHNO3���������ʵ���Ϊ0.05L��0.2mol/L=0.01mol��NaOH���ʵ���Ϊ0.055L��0.2mol/L=0.011mol��0.1mol������ȫ��Ӧ���ҷų�����ΪakJ����1mol���ᷴӦ�ų�����Ϊ100a kJ����Ӧ�Ȼ�ѧ����ʽΪ��NaOH��aq��+HNO3��aq��=NaNO3 ��aq��+H2O��l����H=-100akJ/mol��
�ʴ�Ϊ��NaOH��aq��+HNO3��aq��=NaNO3 ��aq��+H2O��l����H=-100akJ/mol��
��4����0.1mol•L-1 Na2CO3 ����Һ�У�CO32-ˮ�⣺CO32-+H2O  HCO3-+OH-����Һ�ʼ��ԣ���c��OH-����c��H+������Һ����������Դ��ˮ�ĵ�����̼�����̼�������ˮ�⣬��c��OH-����c��HCO3-����������Ũ�����������Ũ����С������Һ��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
HCO3-+OH-����Һ�ʼ��ԣ���c��OH-����c��H+������Һ����������Դ��ˮ�ĵ�����̼�����̼�������ˮ�⣬��c��OH-����c��HCO3-����������Ũ�����������Ũ����С������Һ��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
�ʴ�Ϊ��CO32-+H2O  HCO3-+OH-��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
HCO3-+OH-��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
���� ���⿼��ṹλ�����ʹ�ϵӦ�ã��ƶ�Ԫ���ǽ���Ĺؼ�����Ŀ�漰���û�ѧ���Ԫ�������ɡ�����ˮ��ȣ��Ѷ��еȣ���4��������Ũ�ȱȽϣ�ͨ�����ǣ�����ʵ��롢����ˮ�⡢ˮ�ĵ��롢����غ㡢�����غ㡢���Ӻ��ʽ��

| A�� | 4 | B�� | 5 | C�� | 6 | D�� | 7 |
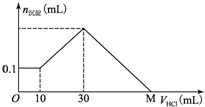 ijһ�������ʿ�����NaOH��AlCl3��MgCl2�еļ�����ɣ�ȡһ�����ù�����������ˮ���г�������������������Һ����μ���5mol/L�����ᣬ��ͼ��ʾ������������������ı仯��ϵ��ͼ��M���ʾ�Ѽ����������������M�������ǣ�������
ijһ�������ʿ�����NaOH��AlCl3��MgCl2�еļ�����ɣ�ȡһ�����ù�����������ˮ���г�������������������Һ����μ���5mol/L�����ᣬ��ͼ��ʾ������������������ı仯��ϵ��ͼ��M���ʾ�Ѽ����������������M�������ǣ�������| A�� | 70 mL | B�� | 100 mL | C�� | 120 mL | D�� | 130 mL |
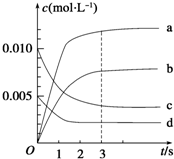 ��2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����H��0����ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����H��0����ϵ�У�n��NO����ʱ��ı仯�����| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
a��v��NO2��=2v��O2�� b��������ѹǿ���ֲ���
c��v����NO��=2v����O2�� d�����������ʵ��ܶȱ��ֲ���
��2��ͼ�б�ʾNO2�ı仯��������b��
��3����O2��Ũ�ȱ仯��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v=0.0015mol•L-1•s-1��
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����ac
a�������������Ϊ1Lb���ʵ������¶�c������O2��Ũ��d��ѡ���Ч�Ĵ�����
| A�� | ���Ȼ�����Һ�еμӹ�����ˮ��Al3++3NH3•H2O=Al��OH��3��+3NH4+ | |
| B�� | ����ͨ��ˮ�У�Cl2+H2O?2H++Cl-+ClO- | |
| C�� | ������ʯ��ˮ��ͨ�����CO2��CO2+OH-=HCO3- | |
| D�� | ���ۺ�Ũ���ᷴӦ��Fe+2H+=Fe2++H2�� |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10�� | 80.5 | 21.2 | 35.7 | 31.0 |
| 100�� | 175 | 246 | 39.1 | 56.6 |
ijͬѧ��������ʵ���֮��Ϊ1��1�������ƺ��Ȼ���Ϊԭ�ϣ�����һ������ˮ��ȡ����ص�ʵ�飬����������ͼ��ʾ��
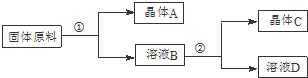
��1���ڢٺ͢ڵ�ʵ������У���Ҫ���ƵĹؼ���ʵ�������ǿ����¶ȣ������������У�C���A����C����ӦΪ����ؾ��壮
��2���ڢٵ�ʵ������У���Ҫ���еIJ��������Ǽ�ˮ�ܽ⡢����Ũ�������ȹ��ˣ�
��3���ֲ�Ʒ�п��ܺ�����������Na+��Cl-����������һ�����ӵķ������ýྻ�IJ�˿����˿պȡ�ֲ�Ʒ�ڻ��������գ�������ʻ�ɫ��֤����Na+���� ȡ�ֲ�Ʒ��������ˮ�����Һ�����������ữ����������Һ�����а�ɫ����������֤����Cl-��
��4��Ϊ��ϴ�����õ�����ؾ��壬�����ܼ�������ϴ�Ӽ�����bc�����ţ���
a����ˮ b����ˮ c��95%�ľƾ� d�����Ȼ�̼��
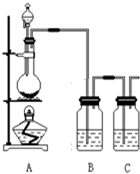 Ϊ����֤��Ԫ�صķǽ����Աȵ�Ԫ�صķǽ�����ǿ��ij��ѧʵ��С���������������Լ����������ʵ�飬��ش��������⣺
Ϊ����֤��Ԫ�صķǽ����Աȵ�Ԫ�صķǽ�����ǿ��ij��ѧʵ��С���������������Լ����������ʵ�飬��ش��������⣺