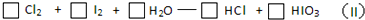题目内容
物质:①BaSO4 ②I2 ③NaHSO3 ④Ca(OH)2 ⑤NaHSO4 ⑥NH3 ⑦C2H5OH
(1)上述物质是强电解质的有: .(填物质序号)
(2)写出指定物质在水溶液中的电离方程式:BaSO4: ;NaHSO3: .
(3)分别取 0.01mol NaOH固体投入到 100mL 0.1mol?L-1的下列液体中,恢复到室温,溶液导电能力基本不变的是 .
A.NaHSO4 B.HCl C.CH3COOH D.H2S E.H2O
(4)pH=l的盐酸平均分成2份,一份加水,另一份加入与该盐酸物质的量浓度相同的NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积近似比为 .
(5)若向SO2的饱和溶液中加入少量的I2,则溶液中
将 (填“增大、减小、不变”).
(1)上述物质是强电解质的有:
(2)写出指定物质在水溶液中的电离方程式:BaSO4:
(3)分别取 0.01mol NaOH固体投入到 100mL 0.1mol?L-1的下列液体中,恢复到室温,溶液导电能力基本不变的是
A.NaHSO4 B.HCl C.CH3COOH D.H2S E.H2O
(4)pH=l的盐酸平均分成2份,一份加水,另一份加入与该盐酸物质的量浓度相同的NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积近似比为
(5)若向SO2的饱和溶液中加入少量的I2,则溶液中
| c(H2SO3) |
| c(HSO3-) |
考点:酸碱混合时的定性判断及有关ph的计算,电离方程式的书写,化学方程式的有关计算,强电解质和弱电解质的概念
专题:计算题,电离平衡与溶液的pH专题
分析:(1)在水溶液中能够全部电离的电解质是强电解质;
(2)BaSO4和NaHSO3是强电解质,在溶液中完全电离;
(3)溶液的导电能力与离子的浓度成正比,离子浓度越大导电能力越强,浓度越小导电能力越弱,向下列溶液中加入氢氧化钠固体后,如果能增大溶液中离子浓度,则能增大溶液的导电能力,否则不能增大溶液的导电能力;
(4)此题为溶液PH的计算,包含两部分,一种为溶液的稀释,另一种为酸碱溶液的混合,计算时前者根据溶质的物质的量不变,后者计算反应后剩余的酸的物质的量和溶液的体积进行计算;
(5)向SO2的饱和溶液中加入少量的I2,反应为SO2+I2+2H2O=SO42-+4H++2I-,根据SO2+H2O?H2SO3?HSO3-+H+平衡移动分析.
(2)BaSO4和NaHSO3是强电解质,在溶液中完全电离;
(3)溶液的导电能力与离子的浓度成正比,离子浓度越大导电能力越强,浓度越小导电能力越弱,向下列溶液中加入氢氧化钠固体后,如果能增大溶液中离子浓度,则能增大溶液的导电能力,否则不能增大溶液的导电能力;
(4)此题为溶液PH的计算,包含两部分,一种为溶液的稀释,另一种为酸碱溶液的混合,计算时前者根据溶质的物质的量不变,后者计算反应后剩余的酸的物质的量和溶液的体积进行计算;
(5)向SO2的饱和溶液中加入少量的I2,反应为SO2+I2+2H2O=SO42-+4H++2I-,根据SO2+H2O?H2SO3?HSO3-+H+平衡移动分析.
解答:
解:(1)在水溶液中能够全部电离的电解质是强电解质,所以属于强电解质的有:①BaSO4 ③NaHSO3 ④Ca(OH)2 ⑤NaHSO4 ,
故答案为:①③④⑤;
(2)BaSO4和NaHSO3是强电解质,在溶液中完全电离,其电离方程式为:BaSO4=Ba2++SO42-,NaHSO3=Na++HSO3-;
故答案为:BaSO4=Ba2++SO42-,NaHSO3=Na++HSO3-;
(3)A.NaHSO4与氢氧化钠固体反应生成硫酸钠,溶液中离子浓度基本不变,所以导电能力基本不变,故A符合;
B.氯化氢是强电解质,氢氧化钠是强电解质,向盐酸中加入氢氧化钠固体后,氢氧化钠和盐酸反应生成氯化钠和水,溶液中离子浓度变化不大,所以溶液的导电能力变化不大,故B符合;
C.醋酸是弱电解质,氢氧化钠和醋酸反应生成醋酸钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故C不符合;
D.H2S是弱电解质,氢氧化钠和H2S反应生成硫化钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故D不符合;
E.水是弱电解质,向水中加入氢氧化钠固体后,溶液中离子浓度增大,则溶液的导电能力增大,故E不符合;
故答案为:AB;
(4)根据题意盐酸平均分成2份,设每份都为1L,将pH=l的盐酸加适量的水,pH升高了1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍,即水的体积为9L;
另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1.可设碱液体积x.依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL=10-2mol/L×(1+x)L,
解之得x=
L,则加入的水与NaOH溶液的体积比为9:
=11:1;
故答案为:11:1;
(5)向SO2的饱和溶液中加入少量的I2,反应为SO2+I2+2H2O=SO42-+4H++2I-,SO2的饱和溶液存在SO2+H2O?H2SO3?HSO3-+H+,由于溶液中氢离子浓度增大,抑制了亚硫酸的电离,所以溶液中
将增大;
故答案为:增大.
故答案为:①③④⑤;
(2)BaSO4和NaHSO3是强电解质,在溶液中完全电离,其电离方程式为:BaSO4=Ba2++SO42-,NaHSO3=Na++HSO3-;
故答案为:BaSO4=Ba2++SO42-,NaHSO3=Na++HSO3-;
(3)A.NaHSO4与氢氧化钠固体反应生成硫酸钠,溶液中离子浓度基本不变,所以导电能力基本不变,故A符合;
B.氯化氢是强电解质,氢氧化钠是强电解质,向盐酸中加入氢氧化钠固体后,氢氧化钠和盐酸反应生成氯化钠和水,溶液中离子浓度变化不大,所以溶液的导电能力变化不大,故B符合;
C.醋酸是弱电解质,氢氧化钠和醋酸反应生成醋酸钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故C不符合;
D.H2S是弱电解质,氢氧化钠和H2S反应生成硫化钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故D不符合;
E.水是弱电解质,向水中加入氢氧化钠固体后,溶液中离子浓度增大,则溶液的导电能力增大,故E不符合;
故答案为:AB;
(4)根据题意盐酸平均分成2份,设每份都为1L,将pH=l的盐酸加适量的水,pH升高了1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍,即水的体积为9L;
另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1.可设碱液体积x.依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL=10-2mol/L×(1+x)L,
解之得x=
| 9 |
| 11 |
| 9 |
| 11 |
故答案为:11:1;
(5)向SO2的饱和溶液中加入少量的I2,反应为SO2+I2+2H2O=SO42-+4H++2I-,SO2的饱和溶液存在SO2+H2O?H2SO3?HSO3-+H+,由于溶液中氢离子浓度增大,抑制了亚硫酸的电离,所以溶液中
| c(H2SO3) |
| c(HSO3-) |
故答案为:增大.
点评:本题考查了强弱电解质的判断、电离方程式的书写、溶液导电性的判断、酸碱混合溶液的计算等,题目涉及的知识点较多,题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
在体积一定的密闭容器中加入一定量的物质A、B、C,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴是指( )
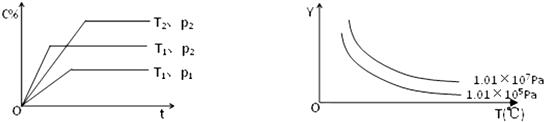

| A、反应物A的百分含量 |
| B、反应体系内分子的总数目 |
| C、平衡混合气体的密度 |
| D、平衡混合气体的平均摩尔质量 |
设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A、2.7g金属铝与足量盐酸反应失去的电子数为0.3NA | ||
| B、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | ||
| C、0.5mol/L Fe2(SO4)3溶液中,SO42-的数目为1.5NA | ||
D、C2H4和C3H6的混合物ag,所含原子总数为
|
由下列反应:Cu+2FeCl3→2FeCl2+CuCl2,CuCl2+Fe→FeCl2+Cu,确定Fe2+、Fe3+、Cu2+的氧化性强弱顺序为( )
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Cu2+>Fe2+ |
| C、Fe3+>Fe2+>Cu2+ |
| D、Fe2+>Fe3+>Cu2+ |