题目内容
已知下列反应:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O (I)
(1)反应(I)中的氧化剂是
(2)根据反应(I)计算,若生成标准状况下33.6L氯气时,电子转移数目是
(3)将反应(II)配平
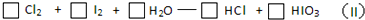
(4)反应(II) 中 发生氧化反应
(5)HCl、I2、CoCl2三种物质的还原性由强到弱的顺序是 .
(1)反应(I)中的氧化剂是
(2)根据反应(I)计算,若生成标准状况下33.6L氯气时,电子转移数目是
(3)将反应(II)配平
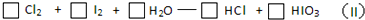
(4)反应(II) 中
(5)HCl、I2、CoCl2三种物质的还原性由强到弱的顺序是
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O中,Co元素的化合价由+3价降低为+2价,Cl元素的化合价由-1价升高到0价,反应(Ⅱ)中,I元素化合价升高,被氧化,Cl元素化合价降低,被还原,以此解答该题.
解答:
解:(1)Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O中,Co元素的化合价由+3价降低为+2价,被还原,Co2O3为氧化剂,故答案为:Co2O3;
(2)若生成标准状况下33.6L氯气时,n(Cl2)=
=1.5mol,转移电子3mol,数目为3NA,故答案为:3 NA;
(3)反应(Ⅱ)中,I元素化合价由0价升高到+5价,被氧化,Cl元素化合价由0价降低到-1价,被还原,氧化剂和还原剂得失电子数目相等,方程式为5Cl2+2I2+6H2O=6HCl+2HIO3,
故答案为:5;2;6;6;2;
(4)反应I元素化合价升高,I2被氧化,故答案为:I2;
(5)由反应Ⅰ只还原性HCl>CoCl2,由反应Ⅱ知还原性I2>HCl,故答案为:I2、HCl、CoCl2.
(2)若生成标准状况下33.6L氯气时,n(Cl2)=
| 33.6L |
| 22.4L/mol |
(3)反应(Ⅱ)中,I元素化合价由0价升高到+5价,被氧化,Cl元素化合价由0价降低到-1价,被还原,氧化剂和还原剂得失电子数目相等,方程式为5Cl2+2I2+6H2O=6HCl+2HIO3,
故答案为:5;2;6;6;2;
(4)反应I元素化合价升高,I2被氧化,故答案为:I2;
(5)由反应Ⅰ只还原性HCl>CoCl2,由反应Ⅱ知还原性I2>HCl,故答案为:I2、HCl、CoCl2.
点评:本题考查氧化还原反应的配平、计算、氧化性强弱的比较等知识点,为高频考点,侧重于学生的分析能力的考查,根据得失电子数相等及原子守恒配平即可,难度不大.

练习册系列答案
相关题目
下列能表示阿伏加德罗常数数值的是( )
| A、1molH2含有的电子数 |
| B、通常状况下,22.4LCO2所含的分子数 |
| C、0.012kg12C所含的原子数 |
| D、1LO.5mol?L-1的CaCl2溶液所含的Cl-数 |
常温下,下列各组离子在给定条件下能大量共存的是( )
| A、在pH=1的溶液中:NH4+、K+、Ba2+、Cl- |
| B、在滴加石蕊试液显红色的溶液中:K+、NH4+、CO32-、SO42- |
| C、有NO3-存在的溶液中:H+、Ba2+、Cl-、SO32- |
| D、在c(H+)=1.0×10-3mol?L-1的溶液中:Na+、K+、SO42-、[Al(OH)4]- |