题目内容
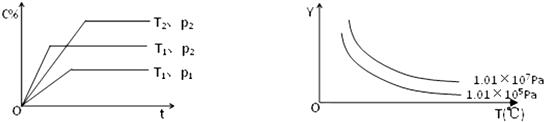
在体积一定的密闭容器中加入一定量的物质A、B、C,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴是指( )

| A、反应物A的百分含量 |
| B、反应体系内分子的总数目 |
| C、平衡混合气体的密度 |
| D、平衡混合气体的平均摩尔质量 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:首先根据C的百分含量--时间变化曲线判断方程式的特征:在相同温度线,增大压强(P2<P1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b<x,
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,在此基础上进一步判断Y随温度、压强的变化.
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,在此基础上进一步判断Y随温度、压强的变化.
解答:
解:由C的百分含量--时间变化曲线可知:在相同温度线,增大压强(P2<P1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b<x,
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,则
A.由C的百分含量--时间变化曲线可知,增大压强平衡向逆反应方向移动,A的百分含量增加,与图象相符,故A正确;
B.由C的百分含量--时间变化曲线可知,增大压强平衡向逆反应方向移动,a+b<x,反应体系内分子的总数目应该是减小,与图象不符,故B错误;
C.由于反应容器的体积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,故C错误;
D.升高温度,平衡向逆反应分析移动,则混合气体的物质的量减小,质量不变,则平衡混合气的平均摩尔质量增大,增大压强,平衡向逆反应方向移动,气体的总物质的量减小,则平衡混合气的平均摩尔质量增大,与图象不符合,故D错误.
故选A.
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,则
A.由C的百分含量--时间变化曲线可知,增大压强平衡向逆反应方向移动,A的百分含量增加,与图象相符,故A正确;
B.由C的百分含量--时间变化曲线可知,增大压强平衡向逆反应方向移动,a+b<x,反应体系内分子的总数目应该是减小,与图象不符,故B错误;
C.由于反应容器的体积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,故C错误;
D.升高温度,平衡向逆反应分析移动,则混合气体的物质的量减小,质量不变,则平衡混合气的平均摩尔质量增大,增大压强,平衡向逆反应方向移动,气体的总物质的量减小,则平衡混合气的平均摩尔质量增大,与图象不符合,故D错误.
故选A.
点评:本题考查化学平衡的变化图象题目,题目难度不大,注意曲线的变化趋势,把握平衡移动的各物理量的变化.

练习册系列答案
相关题目
下列物质既有氧化性又有还原性的是( )
| A、HCl |
| B、Fe |
| C、Cl- |
| D、Na+ |
下列离子方程式书写正确的是( )
| A、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、向氢氧化钠溶液中通入过量二氧化碳:OH-+CO2=HCO3- |
| C、澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
下列说法正确的是( )
| A、胶体与其它分散系的本质区别是有丁达尔效应,而其它分散系没有 |
| B、胶体粒子的直径小于1nm |
| C、丁达尔效应可用于鉴别胶体和溶液 |
| D、胶粒能通过滤纸,也能通过半透膜 |
在由水电离出的c(H+)=10-13mol?L-1的溶液中一定能够大量存在的离子组是( )
| A、Ba2+、Na+、Cl-、NO3- |
| B、Al3+、Ca2+、SO42-、Br- |
| C、NH4+、K+、HSO3-、CO32- |
| D、Na+、K+、Cl-、I- |
下列有关项目的比较中,错误的是( )
| A、酸性:H2SO4>HClO4 |
| B、氧化性:Fe3+>Fe2+ |
| C、稳定性:HF>HCl |
| D、原子半径:Na>Mg |
下列能表示阿伏加德罗常数数值的是( )
| A、1molH2含有的电子数 |
| B、通常状况下,22.4LCO2所含的分子数 |
| C、0.012kg12C所含的原子数 |
| D、1LO.5mol?L-1的CaCl2溶液所含的Cl-数 |
两种元素原子X和Y,Y原子的第三层比氩原子的第三层少6个电子,Y原子的第二层电子数恰为X原子第二层电子数的2倍,则X、Y的质子数分别为( )
| A、14和12 | B、6和12 |
| C、12和6 | D、8和12 |