题目内容
13.运用树状分类法对下列10种物质进行分类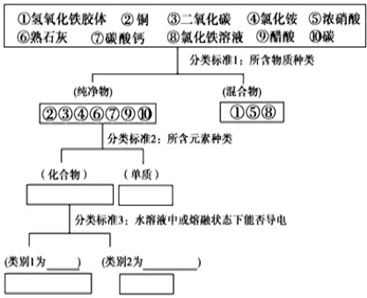
其中,强电解质有:④、⑥、⑦、弱电解质有:⑨,写出③的水化物的电离方程式:H2CO3?H++HCO3-.
分析 在水溶液或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下均不导电的化合物是非电解质;在水溶液中完全电离成离子的电解质属于强电解质,发生部分电离的电解质属于弱电解质,据此分析.
解答 解:在水溶液或熔融状态下能导电的化合物是电解质,如④、⑥、⑦、⑨,在水溶液中完全电离成离子的电解质属于强电解质,如④、⑥、⑦;在溶液中发生部分电离的电解质属于弱电解质如⑨;③二氧化碳与水反应生成碳酸,碳酸在溶液中发生两步电离,以第一步为主,碳酸的电离方程式为:H2CO3?H++HCO3-,
故答案为:④、⑥、⑦;⑨;H2CO3?H++HCO3-.
点评 本题考查了物质的量分类、电解质和非电解质、强电解质和弱电解质等,题目难度不大,侧重于基本概念的考查,考查了学生对基础知识的应用能力.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
3.同温时,pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是( )
| A. | 盐酸>醋酸 | B. | 醋酸>盐酸 | C. | 盐酸=醋 | D. | 无法判断 |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 标准状况下,32gSO2的体积约为22.4L | |
| D. | 物质的量浓度为1mol•L-1的K2SO4溶液中,含2NA个K+ |
1.在配制一定物质的量浓度的NaOH溶液时,下列原因会造成所配溶液浓度偏高的是( )
| A. | 称量NaOH固体时动作过于缓慢 | B. | 向容量瓶中加水定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
8.下列各选项中的两个反应,可用同一个离子方程式表示的是( )
| 选项 | Ⅰ | Ⅱ |
| A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
| B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
| C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
| D | 少量NaHCO3溶液滴入澄清石灰水中 | 少量NaOH溶液滴入Ca(HCO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
18. 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
Ⅰ.废液组成:
Ⅱ.处理方案:
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是产生大量的CO2不利于工业生产.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:Mn2++ClO-+CO32-=MnO2↓+Cl-+CO2↑.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:2Co2++ClO-+2CO32-+3H2O=2Co(OH)3↓+Cl-+2CO2↑;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:Co2++Ni(OH)3=Co(OH)3↓+Ni2+.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是Mn2+,Co2+沉淀完全而Ni2+不被沉淀.
步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:产生大量氢气.
②电解的最佳pH范围是:C (填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.Ⅰ.废液组成:
| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是产生大量的CO2不利于工业生产.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:Mn2++ClO-+CO32-=MnO2↓+Cl-+CO2↑.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:2Co2++ClO-+2CO32-+3H2O=2Co(OH)3↓+Cl-+2CO2↑;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:Co2++Ni(OH)3=Co(OH)3↓+Ni2+.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是Mn2+,Co2+沉淀完全而Ni2+不被沉淀.
步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:产生大量氢气.
②电解的最佳pH范围是:C (填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
3.向密闭容器中充入CO和H2O(g)各0.01 mol,一定温度下发生反应:CO(g)+H2O(g)$?_{高温}^{催化剂}$CO2(g)+H2(g),下列叙述正确的是( )
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |