题目内容
3.向密闭容器中充入CO和H2O(g)各0.01 mol,一定温度下发生反应:CO(g)+H2O(g)$?_{高温}^{催化剂}$CO2(g)+H2(g),下列叙述正确的是( )| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
分析 A.对于反应前后气体不变的反应,容器内的总压强不随时间的变化而改变;
B.催化剂改变反应速率不改变化学平衡;
C.反应前后气体体积不变,则体系的压强会增大平衡不变;
D.设容器体积是1L,根据三行计算得到平衡浓度,结合平衡常数计算,设CO转化x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 0.01 0.01 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.01-x 0.01-x x x
K=$\frac{{x}^{2}}{(0.01-x)^{2}}$=9
x=0.0075
CO的平衡转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:A.对于反应前后气体不变的反应,容器内的总压强不随时间的变化而改变,无论是否平衡,不能说明反应达到平衡状态,故A错误;
B.寻找合适的催化剂是加快反应速率的有效措施,但催化剂不能改变平衡,所以不能提高CO2产率,故B错误;
C.反应前后气体体积不变,则体系的压强会增大,但该反应是前后气体不变的反应,这种情况属等效平衡,新的平衡后CO2的产率不变,故C错误;
D.设容器体积是1L,根据三行计算得到平衡浓度,结合平衡常数计算,设CO转化x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 0.01 0.01 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.01-x 0.01-x x x
K=$\frac{{x}^{2}}{(0.01-x)^{2}}$=9
x=0.0075
CO的平衡转化率α=$\frac{0.0075}{0.01}$×100%=75%,故D正确;
故选D.
点评 本题是考查影响化学反应速率因素和化学平衡知识的综合题,主要是化学平衡移动原理的分析判断,题目难度中等.

| A. | Fe2+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+ ${NH}_{4}^{+}$ HCO${\;}_{3}^{-}$ Cl- | |
| B. | 含有大量ClO-的溶液中:K+ OH- Na+ ${SO}_{3}^{2-}$ | |
| C. | c(Al3+)=0.1 mol?L-1的溶液中:Na+ NO${\;}_{3}^{-}$ AlO${\;}_{2}^{-}$ ${SO}_{4}^{2-}$ | |
| D. | 澄清透明的溶液中:Cu2+ Fe3+ NO${\;}_{3}^{-}$ Cl- |
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
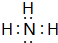 .
.(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值).
①可用Q和X的单质在800~1 000℃制得,每生成1 mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1 600~1 750℃生成QX,每消耗18 g碳生成1 mol QX,吸收b kJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H=(2b-2a) kJ/mol.
(4)X、Y组成的一种无色气体遇空气变为红棕色.标准状况下将40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式8NO+3O2+8OH-=2NO2-+6NO3-+4H2O.
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 丁达尔现象可以用来区别胶体和溶液 | |
| C. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
| A. | 6 mol/L | B. | 3 mol/L | C. | 2.25mol/L | D. | 1.13 mol/L |
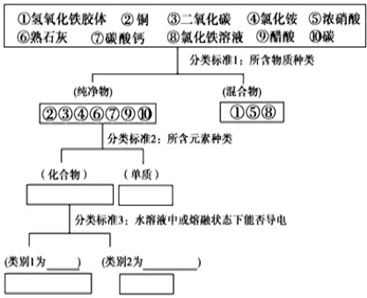
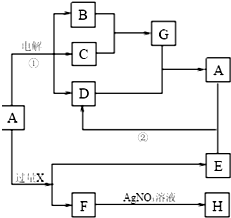 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行):
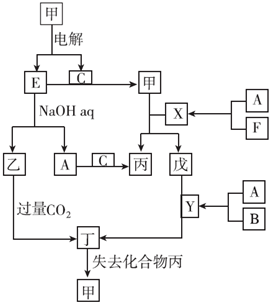
已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行): .
.