题目内容
向一定量Fe、Fe2O3的混合物中加入250mL 2mol?L-1的HNO3溶液,反应完成后生成1.12L(标准状况下)NO气体,再向反应后溶液中加入1mol?L-1 NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液体积最少是( )
| A、450 mL |
| B、500 mL |
| C、400 mL |
| D、不能确定 |
考点:有关混合物反应的计算
专题:守恒法
分析:反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NO,加入NaOH后使铁元素完全沉淀下来,此时溶液的溶质为硝酸钠,根据N元素守恒可知n(NaOH)=n(NO3-)=n(HNO3)-n(NO),再根据V=
进行计算.
| n |
| V |
解答:
解:250mL 2mol?L-1的HNO3溶液中含有HNO3的物质的量为:0.25L×2mol/L=0.5mol,
生成NO的物质的量为:
=0.05mol,
所以与一定量Fe、Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为:0.5mol-0.05mol=0.45mol,
再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,
所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.45mol,
则所加NaOH溶液的体积最少是:
=0.45L=450mL,
故选A.
生成NO的物质的量为:
| 1.12L |
| 22.4L/mol |
所以与一定量Fe、Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为:0.5mol-0.05mol=0.45mol,
再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,
所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.45mol,
则所加NaOH溶液的体积最少是:
| 0.45mol |
| 1mol/L |
故选A.
点评:本题考查化合物反应的计算,题目难度不大,注意掌握有关混合物反应的计算方法,本题利用N元素质量守恒计算较为简单,关键是找出n(NaOH)=n(NO3-)的关系.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
有关化学用语正确的是( )
| A、乙烯的最简式:C2H4 |
B、四氯化碳的电子式: |
| C、乙醇的分子式:C2H6O |
| D、乙炔的结构简式:C2H2 |
用铂作电极电解下列溶液,一段时间后阴极产生的气体体积是阳极产生的气体的两倍的是( )
| A、NaOH |
| B、CuCl2 |
| C、HCl |
| D、CuSO4 |
人们对于化学科学有各种各样的认识,其中错误的是( )
| A、化学面对改善人们生活显得生机勃勃,面对自然环境的日益恶化无能为力 |
| B、化学是一门以实验为基础的自然科学,可以培养学生动手能力 |
| C、化学是一门具有极强实用性的科学,应该予以重视 |
| D、化学将在能源、资源的合理开发和安全应用方面大显身手 |
下列做法中不利于我们生存环境保护的是( )
| A、鼓励家庭生活垃圾分类收集 |
| B、发展“低碳经济”,减小火力发电占总发电量的比例 |
| C、严禁焚烧桔杆,降低空气中PM2.5的浓度 |
| D、用化工厂未“达标”排放的废水灌溉农田 |
某元素X的逐级电离能如图所示,下列说法正确的是( )


| A、X元素可能易形成X4+离子 |
| B、X可能VA族元素 |
| C、X为第五周期元素 |
| D、X与氯反应时可能生成XCl3 |
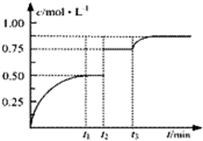 一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A、t1~t3间该反应的平衡常数均为4 |
| B、反应方程式中的x=1 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量物质D |