题目内容
将镁、铝、硅的混合物分为等质量的两份.一份与足量NaOH溶液反应,另一份与足量盐酸反应,最后生成的氢气一样多.则镁与硅物质的量之比为( )
| A、2:1 | B、4:1 |
| C、1:1 | D、3:1 |
考点:有关混合物反应的计算
专题:计算题
分析:硅、铝与氢氧化钠反应生成氢气,铁不与氢氧化钠反应;Mg、铝与稀盐酸反应生成氢气,硅不与盐酸反应,两过程生成的氢气相等,反应中Al都表现+3价,铝与氢氧化钠、盐酸反应生成的氢气相等,则Mg与盐酸反应生成的氢气等于硅氢氧化钠反应生成的氢气,反应中Mg表现+2价、硅表现+4价,根据电子转移守恒计算铁与硅的物质的量之比.
解答:
解:Si、Al与NaOH溶液反应生成氢气,Mg不与氢氧化钠反应,
Mg、Al与稀盐酸反应生成氢气,硅不与盐酸反应,两过程生成的氢气相等,反应中Al都表现+3价,铝与氢氧化钠、盐酸反应生成的氢气相等,则Mg与盐酸反应生成的氢气与硅、氢氧化钠反应生成的氢气的物质的量相等,
反应中Mg表现+2价、硅表现+4价,根据电子转移守恒有:
n(Mg)×2=n(Si)×4,
则:n(Fe):n(Si)=2:1,
故选A.
Mg、Al与稀盐酸反应生成氢气,硅不与盐酸反应,两过程生成的氢气相等,反应中Al都表现+3价,铝与氢氧化钠、盐酸反应生成的氢气相等,则Mg与盐酸反应生成的氢气与硅、氢氧化钠反应生成的氢气的物质的量相等,
反应中Mg表现+2价、硅表现+4价,根据电子转移守恒有:
n(Mg)×2=n(Si)×4,
则:n(Fe):n(Si)=2:1,
故选A.
点评:本题考查混合物的有关计算,题目难度不大,明确发生反应及反应原理为解答关键,注意电子转移守在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
相关的离子检验结论可靠的是( )
| A、往某溶液中加入盐酸,产生无色气体,说明原溶液中含有CO32- |
| B、往某溶液中加入KSCN溶液,显血红色,说明原溶液中含有Fe3+ |
| C、往某溶液中加入BaCl2溶液,产生白色沉淀,说明原溶液中含有SO42- |
| D、往某溶液中加入AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl- |
人们对于化学科学有各种各样的认识,其中错误的是( )
| A、化学面对改善人们生活显得生机勃勃,面对自然环境的日益恶化无能为力 |
| B、化学是一门以实验为基础的自然科学,可以培养学生动手能力 |
| C、化学是一门具有极强实用性的科学,应该予以重视 |
| D、化学将在能源、资源的合理开发和安全应用方面大显身手 |
某元素X的逐级电离能如图所示,下列说法正确的是( )


| A、X元素可能易形成X4+离子 |
| B、X可能VA族元素 |
| C、X为第五周期元素 |
| D、X与氯反应时可能生成XCl3 |
下列表格中烷烃的一氯代物只有一种,仔细分析其结构和组成的变化规律,判断第4位烷烃的分子式是( )
 |  |  | … |
| 1 | 2 | 3 | … |
| A、C23H48 |
| B、C33H68 |
| C、C43H88 |
| D、C53H108 |
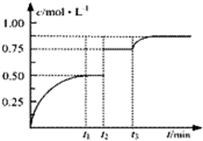 一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A、t1~t3间该反应的平衡常数均为4 |
| B、反应方程式中的x=1 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量物质D |
下列做法中.不会造成大气污染的是( )
| A、燃烧含硫的煤 |
| B、焚烧树叶 |
| C、燃烧氢气 |
| D、燃放烟花爆竹 |
下列检验离子的方法及现象描述正确的是( )
| A、检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 |
| B、检验Cl-:加入AgNO3溶液出现白色沉淀 |
| C、检验Na+:将干净的铂丝蘸取少量溶液灼烧,观察火焰呈黄色 |
| D、检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
 根据如图填空.
根据如图填空.