题目内容
 图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )| A、导线上的电流方向为A→B |
| B、A中SO42-浓度有所减小 |
| C、盐桥中Cl-向A中移动 |
| D、B中铜片质量有所增加 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,发生氧化反应,铜是正极,发生还原反应,根据原电池的工作原理来回答.
解答:
解:A.Zn为负极,Cu为正极,则导线上的电流方向为B→A,故A错误;
B.原电池工作时,阴离子向负极移动,A中SO42-浓度基本不变,故B错误;
C.原电池工作时,阴离子向负极移动,盐桥中的氯离子可向A移动,故C正确;
D.Cu为正极,铜离子在正极发生还原反应生成铜,则B中铜片质量有所增加,故D正确.
故选CD.
B.原电池工作时,阴离子向负极移动,A中SO42-浓度基本不变,故B错误;
C.原电池工作时,阴离子向负极移动,盐桥中的氯离子可向A移动,故C正确;
D.Cu为正极,铜离子在正极发生还原反应生成铜,则B中铜片质量有所增加,故D正确.
故选CD.
点评:本题考查学生盐桥原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.

练习册系列答案
相关题目
下列表述错误的是( )
| A、CS2的结构式为:S=C=S | |||
B、6CO2+6H2O
| |||
| C、CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下能自发进行 | |||
| D、NH3水溶液呈碱性的原因是NH3+H2O?NH3?H2O?NH4++OH- |
难溶化合物的溶解能力可以用溶度积Ksp来表示,当溶液中相应离子浓度的乘积大于该值时,会形成沉淀.已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17.若在常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是( )
| A、被氧化的元素和被还原的元素的质量之比5:1 |
| B、Cl2既是氧化产物,又是还原产物 |
| C、盐酸既体现酸性,又体现还原性 |
| D、转移5mol电子时,产生67.2L的Cl2 |
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
下列变化过程中未必吸热的是( )
| A、电解质在熔融状态下电离 |
| B、共价键断裂 |
| C、原子失电子 |
| D、溶解 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为.有关咖啡酸的说法中不正确的是( )
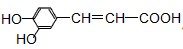
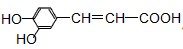
| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1mol咖啡酸可与4mol H2发生加成反应 |
| D、1mol咖啡酸最多能消耗3mol的NaHCO3 |