题目内容
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液(E),某学生设计如下实验方案:

(1)操作①主要是将固体溶解,则所用的主要玻璃仪器是 、 .
(2)操作②~④所加的试剂顺序可以为 , , (填写试剂的化学式).
(3)如何判断SO42-已除尽
(4)实验过程中产生的多次沉淀 (选填“需要”或“不需要”)多次过滤,理由是 .
(5)该同学的实验设计方案中某步并不严密,请说明理由 .

(1)操作①主要是将固体溶解,则所用的主要玻璃仪器是
(2)操作②~④所加的试剂顺序可以为
(3)如何判断SO42-已除尽
(4)实验过程中产生的多次沉淀
(5)该同学的实验设计方案中某步并不严密,请说明理由
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)溶解固体常用烧杯,而为了加速其溶解通常用玻璃棒来搅拌,可以据此答题;
(2)除镁离子用氢氧根,除硫酸根用钡离子,因为加入的试剂都是过量的,所以后加的试剂要把先加的试剂所带入的杂质除掉,主要是碳酸钾要在硝酸钡之后加入,这样可以除去多余的钡离子进行解答;
(3)加入硝酸钡溶液检验硫酸根离子是否除尽;
(4)因为几个沉淀反应互不干扰,为了减少操作程序,不需要”)多次过滤;
(5)加入盐酸调节溶液的pH会引进Cl-,制不到纯净的KNO3溶液(E);
(2)除镁离子用氢氧根,除硫酸根用钡离子,因为加入的试剂都是过量的,所以后加的试剂要把先加的试剂所带入的杂质除掉,主要是碳酸钾要在硝酸钡之后加入,这样可以除去多余的钡离子进行解答;
(3)加入硝酸钡溶液检验硫酸根离子是否除尽;
(4)因为几个沉淀反应互不干扰,为了减少操作程序,不需要”)多次过滤;
(5)加入盐酸调节溶液的pH会引进Cl-,制不到纯净的KNO3溶液(E);
解答:
解:将混有K2SO4、MgSO4的KNO3固体溶解,配制成溶液,先加硝酸钡,除去硫酸根,再加氢氧化钠,除去镁离子,再加碳酸钾,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾,硝酸易挥发,加热煮沸,制得纯净的KNO3溶液(E),加入盐酸调节溶液的pH会引进Cl-.
(1)溶解固体药品通常在烧杯中进行,而固体物质溶于水时,在不借助外力帮助下,溶解速率很慢,为加快溶解,配制溶液时使用玻璃棒进行搅拌,使溶解的分子或离子向水中扩散速度加大,从而使物质溶解的速度加快,制得纯净的KNO3溶液(E).
故答案为:烧杯、玻璃棒;
(2)先加硝酸钡,除去硫酸根,再加氢氧化钠,除去镁离子,再加碳酸钠,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾;
先加氢氧化钾,除去镁离子,再加氯化钡,除去硫酸根,再加碳酸钾,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾;
先加入硝酸钡,除去硫酸根,再加碳酸钾,能把钙离子和多余钡离子除去,再加氢氧化钾,除去镁离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾,
故答案为:Ba(NO3)2、K2CO3、KOH或KOH、Ba(NO3)2、K2CO3、或Ba(NO3)2、KOH、K2CO3;
(3)加入过量硝酸钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴Ba(NO3)2溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:静置,取少量上层澄清溶液,再加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽;
(4)几个沉淀分别为BaSO4、BaCO3、Mg(OH)2,这几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序,
故答案为:不需要;因为几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序;
(5)因加入盐酸调节溶液的pH会引进Cl-,制不到纯净的KNO3溶液(E),所以该同学的实验设计方案中该步并不严密,
故答案为:因为加入盐酸调节溶液的pH会引进Cl-;
(1)溶解固体药品通常在烧杯中进行,而固体物质溶于水时,在不借助外力帮助下,溶解速率很慢,为加快溶解,配制溶液时使用玻璃棒进行搅拌,使溶解的分子或离子向水中扩散速度加大,从而使物质溶解的速度加快,制得纯净的KNO3溶液(E).
故答案为:烧杯、玻璃棒;
(2)先加硝酸钡,除去硫酸根,再加氢氧化钠,除去镁离子,再加碳酸钠,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾;
先加氢氧化钾,除去镁离子,再加氯化钡,除去硫酸根,再加碳酸钾,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾;
先加入硝酸钡,除去硫酸根,再加碳酸钾,能把钙离子和多余钡离子除去,再加氢氧化钾,除去镁离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾,
故答案为:Ba(NO3)2、K2CO3、KOH或KOH、Ba(NO3)2、K2CO3、或Ba(NO3)2、KOH、K2CO3;
(3)加入过量硝酸钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴Ba(NO3)2溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:静置,取少量上层澄清溶液,再加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽;
(4)几个沉淀分别为BaSO4、BaCO3、Mg(OH)2,这几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序,
故答案为:不需要;因为几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序;
(5)因加入盐酸调节溶液的pH会引进Cl-,制不到纯净的KNO3溶液(E),所以该同学的实验设计方案中该步并不严密,
故答案为:因为加入盐酸调节溶液的pH会引进Cl-;
点评:本题考查物质的分离、提纯、检验和鉴别,为高频考点,侧重于学生的分析和实验能力的考查,注意把握物质的性质的异同,考虑实验设计的严密性,题目难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
某Na2SO3样品已部分被氧化为Na2SO4,经测定该混合物中含硫25%,则混合物中Na2SO3与Na2SO4的物质的量之比为( )
| A、7:6 | B、6:7 |
| C、7:1 | D、1:7 |
在d轨道中电子排布成 ,而不排成
,而不排成 ,最直接的根据是( )
,最直接的根据是( )
 ,而不排成
,而不排成 ,最直接的根据是( )
,最直接的根据是( )| A、能量最低原理 |
| B、泡利原理 |
| C、构造原理示意图 |
| D、洪特规则 |
下列变化规律正确的是( )
| A、NaCl、MgCl2、MgO熔点由低到高 |
| B、H2O、H2S、H2Se的分解温度及沸点都由高到低 |
| C、O2、I2、Hg、NaCl、SiO2熔点由低到高 |
| D、碳化硅、单晶硅、金刚石、石墨熔点由低到高 |
水的电离平衡曲线如图所示,下列说法正确的是( )
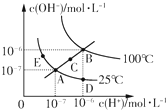

| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从D点到A点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |
 露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式如图:
露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式如图: 如图所示,已知:①甲、乙、丁均是前三周期元素的双原子单质,甲、乙、丙均气体,丁为固体.②在一定的条件下甲与丙和甲与丁都按物质的量之比为1:3反应,分别生成X和Y,在产物中元素甲呈现负价.③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈现负价.请完成下列问题:
如图所示,已知:①甲、乙、丁均是前三周期元素的双原子单质,甲、乙、丙均气体,丁为固体.②在一定的条件下甲与丙和甲与丁都按物质的量之比为1:3反应,分别生成X和Y,在产物中元素甲呈现负价.③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈现负价.请完成下列问题: