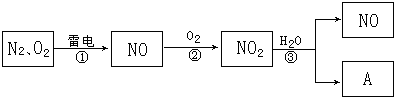
题目内容
5.有反应方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,当32gCu完全反应时,被还原的H2SO4的物质的量为(已知:MCu=64g/mol)( )| A. | 0.5mol | B. | 1.0mol | C. | 1.5mol | D. | 2.0mol |
分析 被还原的H2SO4的物质的量即为生成二氧化硫的物质的量,根据得失电子守恒n(SO2)=n(Cu),由此分析解答.
解答 解:被还原的H2SO4的物质的量即为生成二氧化硫的物质的量,根据得失电子守恒n(SO2)=n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,所以被还原的H2SO4的物质的量为0.5mol,故选A.
点评 本题考查化学方程式的计算,题目难度不大,注意相关物理量的计算公式的运用,牢固把握基础知识.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
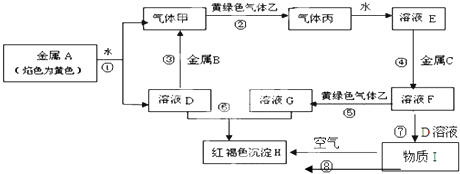
15.某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和Na+.某同学为确定其组分,设计并完成了如下实验:
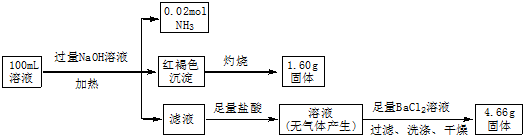
由此可推测原溶液中( )

由此可推测原溶液中( )
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
16.下列书写或说法正确的是( )
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液:2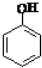 +CO${\;}_{3}^{2-}$→ +CO${\;}_{3}^{2-}$→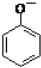 +CO2↑+H2O +CO2↑+H2O | |
| C. | 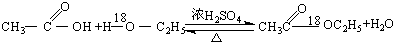 | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
20.四种仪器中,不能用来加热的是( )
| A. |  烧杯 | B. |  容量瓶 | C. |  试管 | D. |  烧瓶 |