题目内容
15.某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和Na+.某同学为确定其组分,设计并完成了如下实验: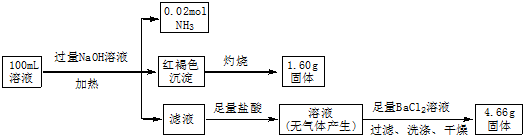
由此可推测原溶液中( )
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe3+,原溶液中一定没有CO32-;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子,由溶液为电中性可判断是否存在氯离子,以此来解答.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe3+,原溶液中一定没有CO32-;由于加入了NaOH,无法判断原溶液中是否含有Na+;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,由电荷守恒,原溶液中一定有Cl-,物质的量至少为 0.02mol×2+0.02mol-0.02mol×2=0.02mol,
A.原溶液中一定存在SO42-、NH4+、Cl-、Fe3+,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故C错误,故A错误;
B.原溶液中一定存在SO42-、NH4+、Cl-、Fe3+,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
C.c(Fe3+)=$\frac{0.02mol}{0.1L}$=0.2mol•L-1,故C错误;
D.由以上分析,原溶液中一定存在0.02molNH4+,0.02molSO42-,0.02molFe3+,所以正电荷物质的量为0.02mol×3+0.02mol=0.08mol,而负电荷的物质的量为0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl-,且c(Cl-)≥$\frac{0.08mol-0.04mol}{0.1L}$=0.4mol•L-1,故D正确;
故选D.
点评 本题考查溶液中成分的确定,为高频考点,注意掌握常见离子的性质及检验方法为解答的关键,注意根据溶液电中性判断氯离子存在,侧重分析、推断能力的综合考查,题目难度中等.

| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |
①热稳定性:H2O>HF>H2S ②结合质子能力:OH->CH3COO->Cl-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O( )
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶质不再溶解,因此从表面看溶质不再减少,也不再增加 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
| A. | 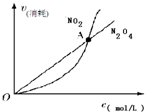 表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 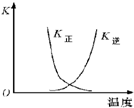 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 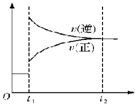 表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 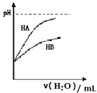 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
| A. | 在五水硫酸铜中滴加少量浓硫酸,固体颜色由蓝变白,说明浓硫酸具有吸水性 | |
| B. | 在未知试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42- | |
| C. | 在铜片上滴加少量稀硫酸,无明显现象,说明稀硫酸没有氧化性 | |
| D. | 某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是 SO2 |
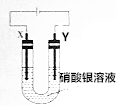 X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )
X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )| A. | Y极附近产生的无色气泡是H2 | |
| B. | X极附近电解质溶液中c(H+)会减小 | |
| C. | 若产生2.24L O2(标准状况下)时析出32.4g银,则电流效率为80% | |
| D. | 阴极的副反应为NO3-+3e-+4H+═NO↑+2H2O |
①分子式符合CxH2x+2Oy
②相对分子质量介于70~100
③氧元素的质量分数为18.18%
④分子中含有2个甲基
⑤能与金属钠反数应放出氢气.
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | 0.5mol | B. | 1.0mol | C. | 1.5mol | D. | 2.0mol |