题目内容
15.下列溶液中的Al3+的物质的量浓度与50mL1mol/L的Al2(SO4)3溶液中的Al3+物质的量浓度相等的是( )| A. | 150mL 1mol/L的AlCl3 | B. | 75mL 2mol/L的Al(NO3)3 | ||
| C. | 50mL 3mol/L的AlCl3 | D. | 50mL 3mol/L的AlBr3 |
分析 50mL1mol/L的Al2(SO4)3溶液中的Al3+物质的量浓度为1mol/L×2=2mol/L,与溶液体积无关,据此分析.
解答 解:50mL1mol/L的Al2(SO4)3溶液中的Al3+物质的量浓度为1mol/L×2=2mol/L.
A、150mL1mol/L的AlCl3中Al3+物质的量浓度为1mol/L×1=1mol/L,与溶液体积无关,故A错误;
B、75mL 2mol/L的Al(NO3)3溶液中Al3+物质的量浓度为2mol/L×1=2mol/L,与溶液体积无关,故B正确;
C、50mL 3mol/L的AlCl3中Al3+物质的量浓度为3mol/L×1=3mol/L,与溶液体积无关,故C错误;
D、50mL 3mol/L的AlBr3中Al3+物质的量浓度为3mol/L×1=3mol/L,与溶液体积无关,故D错误;
故选B.
点评 本题考查物质的量浓度有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
20.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)金属性最强的元素是钙(填元素名称);
(2)第三周期中,最高价氧化物水化物酸性最强的是HClO4(填化学式);
(3)C和N中,原子半径较小的是N;
(4)Si是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)第三周期中,最高价氧化物水化物酸性最强的是HClO4(填化学式);
(3)C和N中,原子半径较小的是N;
(4)Si是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
 .
.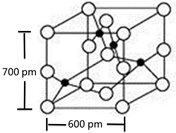 X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题:
X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题: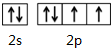 ;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
;Z所在周期中第一电离能最大的主族元素是氯(元素名称)