题目内容
1.将pH=1的HCl和pH=10的Na0H溶液等体积混合,所得溶液的pH=1.3;将pH=5的H2SO4和pH=12的Na0H溶液等体积混合,所得溶液pH=11.7;20mLpH=5的盐酸中加入1滴(0.05mL)0.004mol/LBa(0H)2溶液后pH=9.分析 将pH=1的HCl和pH=10的Na0H溶液等体积混合后,酸过量,故直接求c(H+),然后求pH;将pH=5的H2SO4和pH=12的Na0H溶液等体积混合,碱过量,混合后溶液显碱性,故先求c(OH-),再求c(H+),然后求pH;20mLpH=5的盐酸中加入1滴(0.05mL)0.004mol/LBa(0H)2溶液后,溶液中酸过量,故直接求c(H+),然后求pH,据此分析.
解答 解:将pH=1的HCl和pH=10的Na0H溶液等体积混合后,设溶液体积均为VL,由于酸过量,混合后溶液中c(H+)=$\frac{0.1mol/L×VL-1{0}^{-4}mol/L×VL}{2VL}$≈0.05mol/L,故pH=-lg0.05=2-lg5=1.3;
将pH=5的H2SO4和pH=12的Na0H溶液等体积混合,设溶液体积均为VL,碱过量,混合后溶液显碱性,混合后溶液中的c(OH-)=$\frac{0.01mol/L×VL-1{0}^{-5}mol/L×VL}{2VL}$≈0.005mol/L,则c(H+)≈$\frac{1{0}^{-14}}{0.005}$=2×10-12mol/L,则pH=-lg2×10-12=12-lg2=11.7;
20mLpH=5的盐酸中加入1滴(0.05mL)0.004mol/LBa(0H)2溶液后,溶液中碱过量,故混合后溶液中c(OH-)=$\frac{0.008mol/L×0.05mL×1{0}^{-3}-1{0}^{-5}mol/L×0.02L}{0.02L}$≈10-5mol/L,故溶液中c(H+)≈$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,则pH=9.
故答案为:1.3,11.7,9.
点评 本题考查了酸碱混合后溶液的pH的计算,难度不大,应注意的是混合后溶液显什么性,就先求什么离子的浓度.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案| A. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 铁片放入过量的稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO2↑+4H2O |
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O-+CO32-═H2CO3+2HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
| A. | c1=1mol•L-1 | B. | 2c1>c2 | C. | 2ω1<ω2 | D. | $\frac{{c}_{1}}{{ω}_{1}}$<$\frac{{c}_{2}}{{ω}_{2}}$ |
| A. | 150mL 1mol/L的AlCl3 | B. | 75mL 2mol/L的Al(NO3)3 | ||
| C. | 50mL 3mol/L的AlCl3 | D. | 50mL 3mol/L的AlBr3 |
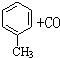 $→_{加热}^{AlCl_{3},HCl}$
$→_{加热}^{AlCl_{3},HCl}$ 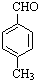 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$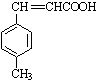 $→_{H_{2}SO_{4},加热}^{CH_{3}OH}$E
$→_{H_{2}SO_{4},加热}^{CH_{3}OH}$E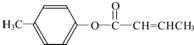 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为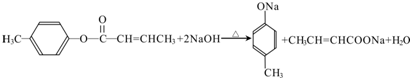 .
.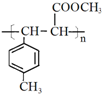 .
.