题目内容
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
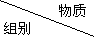 | 甲 | 乙 | 丙 |
| A | MgO | HCl | Al |
| B | Fe | O2 | S |
| C | HCl | NaOH | Ca(HCO3)2 |
| D | AlCl3 | NaOH | NaHCO3 |
| A、A | B、B | C、C | D、D |
考点:镁、铝的重要化合物,钠的重要化合物,铁的化学性质
专题:几种重要的金属及其化合物
分析:A.HCl与Al、MgO均反应,但Al与MgO不反应;
B.Fe与O2、S反应,且O2、S也反应;
C.HCl与NaOH、Ca(HCO3)2反应,且Ca(HCO3)2与NaOH反应;
D.AlCl3与NaOH、NaHCO3反应,且NaOH与NaHCO3反应.
B.Fe与O2、S反应,且O2、S也反应;
C.HCl与NaOH、Ca(HCO3)2反应,且Ca(HCO3)2与NaOH反应;
D.AlCl3与NaOH、NaHCO3反应,且NaOH与NaHCO3反应.
解答:
解:A.Al与HCl反应生成氯化铝和氢气,MgO与HCl溶液反应生成氯化镁和水,但Al与MgO不反应,则不满足组内任意两种物质在一定条件下均能发生反应,故A选;
B.Fe与O2发生氧化还原反应生成四氧化三铁,Fe与S反应生成硫化亚铁,且S与O2反应生成二氧化硫,组内任意两种物质在一定条件下均能发生反应,故B不选;
C.HCl与NaOH反应生成氯化钠和水,HCl与Ca(HCO3)2反应生成氯化钙、二氧化碳和水,且NaOH与Ca(HCO3)2反应生成碳酸钙、碳酸钠和水,组内任意两种物质在一定条件下均能发生反应,故C不选;
D.AlCl3与NaOH反应生成偏铝酸钠和水,AlCl3与NaHCO3发生双水解反应生成氢氧化铝和二氧化碳、水,且NaOH与NaHCO3反应生成碳酸钠和水,组内任意两种物质在一定条件下均能发生反应,故D不选;
故选A.
B.Fe与O2发生氧化还原反应生成四氧化三铁,Fe与S反应生成硫化亚铁,且S与O2反应生成二氧化硫,组内任意两种物质在一定条件下均能发生反应,故B不选;
C.HCl与NaOH反应生成氯化钠和水,HCl与Ca(HCO3)2反应生成氯化钙、二氧化碳和水,且NaOH与Ca(HCO3)2反应生成碳酸钙、碳酸钠和水,组内任意两种物质在一定条件下均能发生反应,故C不选;
D.AlCl3与NaOH反应生成偏铝酸钠和水,AlCl3与NaHCO3发生双水解反应生成氢氧化铝和二氧化碳、水,且NaOH与NaHCO3反应生成碳酸钠和水,组内任意两种物质在一定条件下均能发生反应,故D不选;
故选A.
点评:本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.

练习册系列答案
相关题目
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
CO2↑+2H2O+2SO2↑,则12g木炭和足量的浓硫酸反应后生成的气体在标况下的体积为( )
| ||
| A、22.4 L |
| B、44.8 L |
| C、67.2 L |
| D、89.6 L |
用Na2CO3固体配制一定物质的量浓度的Na2CO3溶液时,不需要使用的玻璃仪器是( )
| A、容量瓶 | B、玻璃棒 |
| C、漏斗 | D、烧杯 |
己知A(s)+2B(g)═C(g)+D(g)反应的平衡常数和温度的关系如下:下列问题不正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A、该反应的平衡常数表达式K=C(C)?C(D)/C2(B) |
| B、该反应的△H<0 |
| C、830℃时,向一个5L的密闭容器中充入10 mol A和2mol B,10min后,B为0.5mol时,此时V(正)>V(逆) |
| D、在温度、容积不变时,气体的密度不随时间改变能判断该反应是否达到平衡 |
在3NO2+H2O=2HNO3+NO↑反应中,氧化剂与还原剂的分子数之比为( )
| A、1:2 | B、2:1 |
| C、3:1 | D、1:3 |
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;