题目内容
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是
A.容器中压强不变B.混合气体中c(CO)不变C.v正(H2)=v逆(H2O)D.c(CO)=c(CO2)
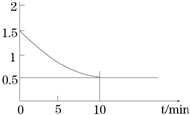
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
①该条件下反应的平衡常数为
②下列措施中能使平衡时
| c(CO) |
| c(CO2) |
A.升高温度B.增大压强C.充入一定量的CO2 D.再加入一定量铁粉.
考点:化学平衡的影响因素,反应热和焓变
专题:基本概念与基本理论
分析:(1)①据已知热化学方程式,利用盖斯定律解答;据化学平衡常数表达式分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①依据平衡常数概念写出,用生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到平衡常数表达式,代入图上数据即可求K;据K求算二氧化碳的平衡浓度;
②
是该反应的平衡常数表达式,平衡常数随温度变化,结合平衡移动原理分析判断.
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①依据平衡常数概念写出,用生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到平衡常数表达式,代入图上数据即可求K;据K求算二氧化碳的平衡浓度;
②
| c(CO) |
| c(CO2) |
解答:
解:(1)①已知①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,据盖斯定律,①-②得:CO2(g)+H2(g)?CO(g)+H2O(g)△H=△H1-△H2;反应的K=
,K1=
,K2=
,所以K=
;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热,故答案为:△H1-△H2;
;吸热;
②A、反应前后气体体积不变,容器中压强始终不变,故A错误;
B、CO浓度不变,说明各气体浓度都不再变化,反应达到平衡状态,故B正确;
C、v正(H2)=v正(H2O)=v逆(H2O),正逆反应速率相等,但不为0,故C正确;
D、c(CO2)=c(CO)可能是平衡状态,也可能不是,与各物质的初始浓度及转化率有关,故D错误;
故答案为:BC;
(2)①据图分析平衡时二氧化碳和CO的浓度分别为0.5mol/L和1mol/L,K=
=
=2.0;若CO2的起始浓度为2.0mol?L-1,据方程式可知,反应的二氧化碳的浓度与生成CO浓度相等,设为xmol/L,则平衡时二氧化碳浓度为(2.0-x)mol/L,K=
=
=2.0,x=
,故答案为:2.0;1.33;
②平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;
A.升高温度,平衡正向进行,平衡常数增大,故A正确;
B.增大压强,平衡不动,平衡常数不变,故B错误;
C.充入一定量CO,平衡逆向进行,但平衡常数不变,故C错误;
D.降低温度,平衡逆向进行,平衡常数减小,故D错误;
故答案为:A.
| [CO]?[H2O] |
| [CO2]?[H2] |
| [CO] |
| [CO2] |
| [H2] |
| [H2O] |
| K1 |
| K2 |
| K1 |
| K2 |
②A、反应前后气体体积不变,容器中压强始终不变,故A错误;
B、CO浓度不变,说明各气体浓度都不再变化,反应达到平衡状态,故B正确;
C、v正(H2)=v正(H2O)=v逆(H2O),正逆反应速率相等,但不为0,故C正确;
D、c(CO2)=c(CO)可能是平衡状态,也可能不是,与各物质的初始浓度及转化率有关,故D错误;
故答案为:BC;
(2)①据图分析平衡时二氧化碳和CO的浓度分别为0.5mol/L和1mol/L,K=
| [CO] |
| [CO2] |
| 1.0mol/L |
| 0.5mol/L |
| [CO] |
| [CO2] |
| x |
| 2.0-x |
| 4 |
| 3 |
②平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;
A.升高温度,平衡正向进行,平衡常数增大,故A正确;
B.增大压强,平衡不动,平衡常数不变,故B错误;
C.充入一定量CO,平衡逆向进行,但平衡常数不变,故C错误;
D.降低温度,平衡逆向进行,平衡常数减小,故D错误;
故答案为:A.
点评:本题考查化学平衡影响因素、平衡状态的判断、化学平衡的计算,题目计算量较大,难度较大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列有关说法正确的是( )
| A、若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H<0 |
| C、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| D、对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
 | 甲 | 乙 | 丙 |
| A | MgO | HCl | Al |
| B | Fe | O2 | S |
| C | HCl | NaOH | Ca(HCO3)2 |
| D | AlCl3 | NaOH | NaHCO3 |
| A、A | B、B | C、C | D、D |
近两年来,“雾霾”一直是人们所关注的对象,如图为雾霾的主要成分示意图.下列说法不正确的是( )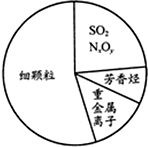

| A、苯是最简单的芳香烃 |
| B、重金属离子可导致蛋白质变性 |
| C、SO2和NxOy均属于酸性氧化物 |
| D、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
已知100mL0.55mol?L-1氢氧化钠溶液与100mL0.5mol?L-1盐酸溶液混合放出热量为a kJ(a>0).下列说法正确的是( )
| A、氢氧化钠和盐酸反应的中和热为a kJ |
| B、若其他条件不变,盐酸体积换成200 mL,则中和热为原来的2倍 |
| C、若其他条件不变,将氢氧化钠溶液换成200 mL,则放出热量2a kJ |
| D、若其他条件不变,将盐酸浓度换成0.55mol?L-1,则中和热不变 |
以下不属于蛋白质变性的是( )
| A、医疗上常用酒精作消毒剂 |
| B、用福尔马林对种子消毒 |
| C、鸡蛋白溶液中加入食盐变浑浊 |
| D、用氯化汞消毒医疗器械 |
下列溶液中Cl-浓度最小的是( )
| A、200mL 2mol/L MgCl2溶液 |
| B、1000mL 2.5mol/L NaCl溶液 |
| C、300mL 5mol/L KCl溶液 |
| D、250mL 1mol/L AlCl3溶液 |