题目内容
18.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一,回答下列问题:(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
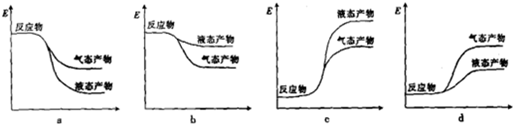
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
分析 (1)①已知:Ⅰ.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ/mol-1
Ⅱ.CH2OH(g)+$\frac{3}{2}$O2═CO2(g)+2H2O(g)△H2=-676kJ/mol-1
根据盖斯定律,Ⅰ×3-Ⅱ可得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g);
②气态产物能量比液态产物能量高,由①分析可知,合成甲醇的反应为放热反应,反应物的能量高于生成物的能量;
③若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,设H2O的浓度变化量为xmol/L,则:
H2O(g)+CO(g)?H2(g)+CO2(g),
起始量(mol/L):2 1 0 0
变化量(mol/L):x x x x
平衡量(mol/L):2-x 1-x x x
再根据平衡常数列方程计算解答;
(2)①由表中数据可知,从2min到4min,CO的浓度变化量为(0.07-0.06)mol/L=0.01mol/L,根据方程式计算氢气的浓度变化量,2min时氢气浓度=4min时氢气浓度+氢气浓度变化量;
4min与6min时,CO浓度相等,则4min、6min时反应处于平衡状态,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,代入平衡浓度计算;
②对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;
计算浓度商Qc,与平衡常数相比判断第8min时是否达到平衡状态;
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:此温度下的催化剂活性高;温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低;
(3)在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度HCOOH溶液混合后所得溶液为HCOONa,溶液中HCOO-水解,溶液呈碱性.
解答 解:(1)①已知:Ⅰ.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ/mol-1
Ⅱ.CH2OH(g)+$\frac{3}{2}$O2═CO2(g)+2H2O(g)△H2=-676kJ/mol-1
根据盖斯定律,Ⅰ×3-Ⅱ可得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
故热化学方程式为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
②气态产物能量比液态产物能量高,由①分析可知,合成甲醇的反应为放热反应,反应物的能量高于生成物的能量,则符合条件的图象是a,
故选:a;
③若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,设H2O的浓度变化量为xmol/L,则:
H2O(g)+CO(g)?H2(g)+CO2(g)
起始量(mol/L):2 1 0 0
变化量(mol/L):x x x x
平衡量(mol/L):2-x 1-x x x
则$\frac{x×x}{(1-x)×(2-x)}$=4,解得x=$\frac{2}{3}$,
故水的转化率为$\frac{\frac{2}{3}mol/L}{2mol/L}$×100%=33.3%,
故答案为:33.3%;
(2)①由表中数据可知,从2min到4min,CO的浓度变化量为(0.07-0.06)mol/L=0.01mol/L,根据方程式可知氢气的浓度变化量为0.01mol/L×2=0.02mol/L,2min时氢气浓度=0.12mol/L+0.02mol/L=0.14mol/L,
4min与6min时,CO浓度相等,则4min、6min时反应处于平衡状态,故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.04}{0.06×0.1{2}^{2}}$=46.3,
故答案为:0.14;46.3;
②对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;
8min时浓度商Qc=$\frac{0.05}{0.05×0.{2}^{2}}$=25<K=46.3,故8min时不是平衡状态,反应向正反应进行,
故答案为:加入1mol氢气;不是;
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:此温度下的催化剂活性高;温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低,
故答案为:温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低;
(3)在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度HCOOH溶液混合后所得溶液为HCOONa,溶液中HCOO-水解:HCOO-+H2O?+HCOOH+OH-,溶液呈碱性,则pH>7,
故答案为:>;HCOO-+H2O?+HCOOH+OH-.
点评 本题考查化学平衡计算及影响因素、平衡常数计算及应用、热化学方程式书写、盐类水解等,是对学生综合能力的考查,难度中等.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.

发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}CrO_{7}}$CH3CH2CH2CHO反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95.C,在E中收集90.C以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77.C馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中?不能 (填“能”或“不能”)说明理由容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”
(5)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(6)本实验中,正丁醛的产率为51.4%.




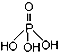 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空: