��Ŀ����
16�������� �ĺϳ�·����ͼ�����ַ�Ӧ����ʡ�ԣ�
�ĺϳ�·����ͼ�����ַ�Ӧ����ʡ�ԣ�
��1��������A�ķ���ʽC8H10���ú˴Ź������ײⶨ������F�����Գ���4�����壮
��2������˵����ȷ����BD��˫ѡ�⣩
A��������A��D��ͬϵ�� B��������C����������Ʒ�Ӧ�ų�����
C��������D�����Է����Ӿ۷�Ӧ D��������F��һ�������¿���ʹ��ˮ��ɫ
��3����Ӧ II�Ļ�ѧ����ʽ��
 ��ע����Ӧ����������
��ע����Ӧ������������4����Ҫ��д��������A���� �ϵ�һ�ȴ���������л���Ľṹ��ʽ
 ��
��
���� ��1������A�Ľṹ��ʽ��֪�����ʽ������F�Ľṹ��ʽ��֪F����ԭ�ӵ����ࣻ
��2��A��������A�в��������ţ�D�й�������̼̼˫�������Dz���ͬϵ�
B��������C�����ǻ�������������Ʒ�Ӧ�ų�������
C��������D�й�������̼̼˫�������Է����Ӿ۷�Ӧ��
D��������F����̼̼�μ�����һ�������¿���ʹ��ˮ��ɫ��
��3����Ӧ II��B����ԭ�ӱ��ǻ�ȡ������C���÷�Ӧ�ڼ�����Һ���ȵ������½��У�
��4�����ݻ�����A�Ľṹ��ʽ������д�������ϵ�һ�ȴ��T��ԭ�����ڱ������л���Ľṹ��ʽ��
��� �⣺��1������A�Ľṹ��ʽ��֪�����ʽΪC8H10������F�Ľṹ��ʽ��֪F����4��λ�õ���ԭ�ӣ������ú˴Ź������ײⶨ������F�����Գ��� 4�����壬
�ʴ�Ϊ��C8H10��4��
��2��A��������A�в��������ţ�D�й�������̼̼˫�������Dz���ͬϵ���A����
B��������C�����ǻ�������������Ʒ�Ӧ�ų���������B��ȷ��
C��������D�й�������̼̼˫�������Է����Ӿ۷�Ӧ����C����
D��������F����̼̼�μ�����һ�������¿���ʹ��ˮ��ɫ����D��ȷ��
��ѡBD��
��3����Ӧ II��B����ԭ�ӱ��ǻ�ȡ������C���÷�Ӧ�ڼ�����Һ���ȵ������½��У���Ӧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4�����ݻ�����A�Ľṹ��ʽ������д�������ϵ�һ�ȴ��T��ԭ�����ڱ������л���Ľṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
��
���� ������Ҫ�������л���ĺϳ�·�ߣ��е��Ѷȣ�����ʱע���л��й��ܵ��ת���ͷ�Ӧ��������ע�����������Ļ���������

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶����ó��������崫������ò�ͬʱ���SO2��COŨ�������
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| c��SO2����mol•L-1�� | 1.00 | 0.50 | 0.23 | 3.00��10-37 | 3.00��10-37 | 3.00��10-37 |
| c��CO����mol•L-1�� | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
��1�������������·�Ӧ�ܹ��Է����У���Ӧ�ġ�H��0����д������������������=������
��2��ǰ2s�ڵ�ƽ����Ӧ����v��CO2��=0.77mol/��L•s����
��3���ڸ��¶��£���Ӧ��ƽ�ⳣ��K=3.33��1036��
��4���������ܱ������з���������Ӧ���ﵽƽ��ʱ�����д�ʩ�Ȳ�����߳ɱ����������SO2ת���ʵ���BC��
A��ѡ�ø���Ч�Ĵ��� B�����n��CO����n��SO2��Ͷ�ϱ�
C�����ͷ�Ӧ��ϵ���¶� D����С���������
��5��Ϊ�˷ֱ���֤��ͬ�������¶ȡ�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ��ʹ��Ӧ��������������ʵ�������Ѿ���������ʵ����Ʊ��У�
| ʵ�� ��� | T���棩 | SO2��ʼŨ�� ��mol•L-1�� | CO��ʼŨ�� ��mol•L-1�� | ���� |
| �� | 260 | 1.00 | 3.00 | Cr2O3 |
| �� | Fe2O3 | |||
| �� | 380 | |||
| �� | 4.00 |
���о�������Fe2O3�Ĵ�Ч������Cr2O3�����ڴ������Ӧλ�û����ϱ��е��ĸ�ʵ�������»��������SO2Ũ����ʱ��仯����������ͼ����������ʵ���ţ�
| A�� | ̼��������Һ��ϡ���ᷴӦ��CO32-+2H+�TH2O+CO2�� | |
| B�� | ̼�����Һ��ϡ���ᷴӦ��CO32-+H+�TCO2��+H2O | |
| C�� | ����ˮ��Ӧ��2Na+2H2O�T2Na++2OH-+H2�� | |
| D�� | ʵ������ȡ������2KClO3$\frac{\underline{\;MnO_{2}\;}}{��}$2K++2Cl-+3O2�� |
| A�� | ij����������Ϊ2��2��4��4-�ļ�-3��3��5-���һ����� | |
| B�� |  ������ֻ�����Ȼ����ǻ����ֹ����� ������ֻ�����Ȼ����ǻ����ֹ����� | |
| C�� | PETG�Ľṹ��ʽΪ�� �ϳ�PETG�ĵ�����4�� �ϳ�PETG�ĵ�����4�� | |
| D�� | ������ ������������ˮ�⣬������Һ�Ӽ�������NH3���� ������������ˮ�⣬������Һ�Ӽ�������NH3���� |
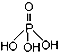 �����������ƣ�NaH2PO2�������ڻ�ѧ�����ȵȣ����������գ�
�����������ƣ�NaH2PO2�������ڻ�ѧ�����ȵȣ����������գ�
