题目内容
3.燃烧下列混合气体所生成的CO2的物质的量,一定大于燃烧相同质量的环丙烷产生的CO2物质的量的是( )| A. | 乙烯与乙炔 | B. | 丙烷与乙炔 | C. | 丙烯与丁烯 | D. | 乙烷与丙烷 |
分析 烃的燃烧反应中,燃烧相同质量的烃,烃中含碳的质量分数越大,生成的CO2量越多,环丙烷C、H原子数目之比为1:2,然后利用极限法根据含碳量高低进行分析.
解答 解:A.乙烯和乙炔中C、H原子数目之比分别为1:2、1:1,所以混合气体的含碳量大于环丙烷,燃烧相同质量的混合气体,所产生CO2的量一定大于燃烧相同质量的环丙烷所产生的CO2,故A正确;
B.丙烷、乙炔分子中C、H原子数目之比分别为1:2.67、1:1,环丙烷C、H原子数目之比为1:2,燃烧相同质量的混合气体所产生CO2的量可能大于、小于或等于燃烧相同质量的环丙烷所产生的CO2,故B错误;
C.丙烯和丁烯分子中C、H原子数目之比均为1:2,环丙烷C、H原子数目之比为1:2,燃烧相同质量的混合气体,所产生CO2的量等于燃烧相同质量的环丙烷所产生的CO2,故C错误;
D.乙烷和丙烷中C、H原子数目之比分别为1:3、3:8,乙烷、丙烷分子中的含碳量小于环丙烷,所以混合气体的含碳量小于环丙烷,燃烧相同质量的混合气体,所产生CO2的量一定小于燃烧相同质量的环丙烷所产生的CO2,故D错误;
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确反应反应的原理为解答关键,注意相同质量的烃燃烧时,烃中含碳的质量分数越大生成的CO2量越多,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
13. 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池负极的反应式为:Pb-2e -→Pb2+ | |
| B. | 铅蓄电池放电时,该电池两极质量均减少 | |
| C. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| D. | 电解苦卤水时,a电极首先放电的是Br- |
11.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c (OH-)=1×10-14 mol•L-1溶液:K+ Na+ Cl- HCO3- |
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
 .请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH
.请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH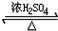 CH3COOCH2CH2CH3+H2O
CH3COOCH2CH2CH3+H2O