题目内容
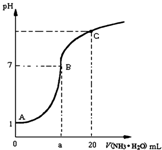 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、根据A点溶液的pH计算滴加前盐酸的物质的量浓度;
B、pH=7,溶液显示中性,根据溶液的组成来判断;
C、A、B间的任一点,溶液显示酸性,根据溶液的组成确定离子浓度的大小;
D、将氨水换为NaOH溶液,根据盐酸和氢氧化钠之间的中和反应进行计算即可.
B、pH=7,溶液显示中性,根据溶液的组成来判断;
C、A、B间的任一点,溶液显示酸性,根据溶液的组成确定离子浓度的大小;
D、将氨水换为NaOH溶液,根据盐酸和氢氧化钠之间的中和反应进行计算即可.
解答:
解:A、A点溶液的pH=1,所以滴加前盐酸的物质的量浓度是0.1mol/L,故A正确;
B、B点pH=7,溶液显示中性,氨水和盐酸反应生成的氯化铵显示酸性,要保证溶液显示中性,应该氨水稍过量,即体积略大于10mL,故B错误;
C、A、B间的任一点,溶液显示酸性,溶液的组成:氯化铵溶液,或是氯化铵和盐酸的混合液,当组成是氯化铵和盐酸的混合液时,存在:c(Cl-)>c (H+)>c(NH4+)>c(OH-),故C错误,
D、将氨水换为NaOH溶液,滴加20mL时,溶液为氢氧化钠和氯化钠的混合物,此时氢氧化钠会剩余,等浓度的氢氧化钠的pH大于氨水的,即应该是大于C点的pH,故D错误.
故选A.
B、B点pH=7,溶液显示中性,氨水和盐酸反应生成的氯化铵显示酸性,要保证溶液显示中性,应该氨水稍过量,即体积略大于10mL,故B错误;
C、A、B间的任一点,溶液显示酸性,溶液的组成:氯化铵溶液,或是氯化铵和盐酸的混合液,当组成是氯化铵和盐酸的混合液时,存在:c(Cl-)>c (H+)>c(NH4+)>c(OH-),故C错误,
D、将氨水换为NaOH溶液,滴加20mL时,溶液为氢氧化钠和氯化钠的混合物,此时氢氧化钠会剩余,等浓度的氢氧化钠的pH大于氨水的,即应该是大于C点的pH,故D错误.
故选A.
点评:本题考查酸碱的混合以及离子浓度的大小比较,题目难度较大,注意盐酸和氨水恰好完全反应时溶液不呈中性,要使溶液呈中性,氨水应稍微过量,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学药品包装瓶上常有一些警示标志.下列化学药品名称与警示标志对应正确的是( )
A、 甲烷 |
B、 浓硫酸 |
C、 汽油 |
D、 烧碱 |
蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应为:NiO2+Fe+2H2O
Fe(OH)2+Ni(OH)2.下列有关该电池的说法中正确的是( )
| 放电 |
| 充电 |
| A、放电时电解质溶液显强酸性 |
| B、充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O |
| C、放电时正极附近溶液pH减小 |
| D、充电时阴极附近溶液的碱性保持不变 |
下列有关物质的性质或应用不正确的是( )
| A、氯气可用于自来水的消毒,明矾或铁盐可用来净化水,可推知K2FeO4既能消毒又能净化水 |
| B、配置FeCl3溶液时为防止出现浑浊,应向溶液中加入盐酸抑制Fe3+的水解 |
| C、向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 |
| D、合成氨生产中将氨气液化分离,提高氢气的转化率 |
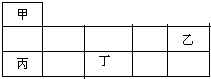 短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )
短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )| A、原子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
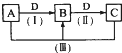 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.