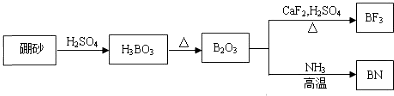
题目内容
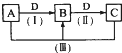 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一种金属元素的无机化合物,反应(Ⅲ)的离子方程式为
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(Ⅲ)中氧化产物与还原产物的物质的量之比为
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为
②25℃时,浓度均为O.1mol/l的B、C溶液,pH较大的是
考点:无机物的推断
专题:推断题
分析:(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,应为氮气和氧气,结合转化关系可知,A为氨气,D为氧气,B为氮气,C为NO;
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,可推知A为铝盐、D为NaOH,B为Al(OH)3,C为NaAlO2;
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,由于最外层电子数不超过8,则B原子只能有3个电子层,最外层电子数为6,可推知B为S,则A为H2S、D为O2、C为SO2;
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,则A为NaOH、D为CO2、B为Na2CO3、C为NaHCO3.
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,可推知A为铝盐、D为NaOH,B为Al(OH)3,C为NaAlO2;
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,由于最外层电子数不超过8,则B原子只能有3个电子层,最外层电子数为6,可推知B为S,则A为H2S、D为O2、C为SO2;
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,则A为NaOH、D为CO2、B为Na2CO3、C为NaHCO3.
解答:
解:(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,应为氮气和氧气,结合转化关系可知,A为氨气,D为氧气,B为氮气,C为NO,则反应(Ⅲ)的化学方程式为:4NH3+6NO═5N2+6H2O,
故答案为:4NH3+6NO═5N2+6H2O;
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,可推知A为铝盐、D为NaOH,B为Al(OH)3,C为NaAlO2,则反应(Ⅲ)的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,由于最外层电子数不超过8,则B原子只能有3个电子层,最外层电子数为6,可推知B为S,则A为H2S、D为O2、C为SO2,则反应(Ⅲ)是2H2S+SO2=3S↓+2H2O,反应中氧化产物与还原产物的物质的量之比为2:1;
由反应:H2S+2NaOH=Na2S+2H2O,H2S+NaOH=NaHS+H2O,H2S与NaOH的物质的量之比=0.1:0.15=1:1.5,故硫化氢与NaOH都完全反应,所得产物为Na2S和NaHS,设所得产物中含Na2S为xmol,NaHS为ymol,则:x+y=0.1,2x+y=0.15,联立方程解得x=y=0.05,HS-的水解程度大于电离程度,S2-水解,其水解程度大于HS-,溶液呈碱性,且c(HS-)>c(S2-),溶液中c(Na+ )最大,故离子浓度:c(Na+ )>c(HS-)>c(S2-)>c(OH-)>c(H+),
故答案为:2:1;c(Na+ )>c(HS-)>c(S2-)>c(OH-)>c(H+);
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,则A为NaOH、D为CO2、B为Na2CO3、C为NaHCO3.
①NaOH中所含化学键类型为:离子键、共价键,D为CO2,电子式为 ,
,
故答案为:离子键、共价键; ;
;
②25℃时,0.1mol?L-1 Na2CO3、NaHCO3溶液,CO32-的水解程度大于HCO3-水解,故Na2CO3溶液的pH较大,由电荷守恒可知,Na2CO3溶液中微粒浓度之间存在的等量关系:c(Na+ )+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),B为Na2CO3,溶液中水电离出来的H+的浓度等于溶液中氢氧根离子的浓度,当B溶液的PH=a,时其水电离出来的H+的浓度为
mol/L=10a-14mol/L,
故答案为:Na2CO3;c(Na+ )+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);10a-14mol/L.
故答案为:4NH3+6NO═5N2+6H2O;
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,可推知A为铝盐、D为NaOH,B为Al(OH)3,C为NaAlO2,则反应(Ⅲ)的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,由于最外层电子数不超过8,则B原子只能有3个电子层,最外层电子数为6,可推知B为S,则A为H2S、D为O2、C为SO2,则反应(Ⅲ)是2H2S+SO2=3S↓+2H2O,反应中氧化产物与还原产物的物质的量之比为2:1;
由反应:H2S+2NaOH=Na2S+2H2O,H2S+NaOH=NaHS+H2O,H2S与NaOH的物质的量之比=0.1:0.15=1:1.5,故硫化氢与NaOH都完全反应,所得产物为Na2S和NaHS,设所得产物中含Na2S为xmol,NaHS为ymol,则:x+y=0.1,2x+y=0.15,联立方程解得x=y=0.05,HS-的水解程度大于电离程度,S2-水解,其水解程度大于HS-,溶液呈碱性,且c(HS-)>c(S2-),溶液中c(Na+ )最大,故离子浓度:c(Na+ )>c(HS-)>c(S2-)>c(OH-)>c(H+),
故答案为:2:1;c(Na+ )>c(HS-)>c(S2-)>c(OH-)>c(H+);
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,则A为NaOH、D为CO2、B为Na2CO3、C为NaHCO3.
①NaOH中所含化学键类型为:离子键、共价键,D为CO2,电子式为
 ,
,故答案为:离子键、共价键;
 ;
;②25℃时,0.1mol?L-1 Na2CO3、NaHCO3溶液,CO32-的水解程度大于HCO3-水解,故Na2CO3溶液的pH较大,由电荷守恒可知,Na2CO3溶液中微粒浓度之间存在的等量关系:c(Na+ )+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),B为Na2CO3,溶液中水电离出来的H+的浓度等于溶液中氢氧根离子的浓度,当B溶液的PH=a,时其水电离出来的H+的浓度为
| 10-14 |
| 10-a |
故答案为:Na2CO3;c(Na+ )+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);10a-14mol/L.
点评:本题考查无机物推断、离子浓度的大小比较等问题,具有一定难度,需要学生熟练掌握元素化合物知识,离子浓度大小比较为易错点,(4)中注意根据物料守恒、电荷守恒确定等量关系.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )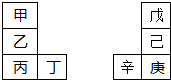

| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
下列实验操作中不正确的是(多选) ( )
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
一定量的稀硫酸跟过量铁粉反应,为了减缓反应速率,又不影响生产氢气的总量,可向稀硫酸中加入适量的( )
| A、CH3COONa(固体) |
| B、NH4Cl(固体) |
| C、CuSO4(溶液) |
| D、Ba(OH)2(固体) |
下列说法不正确的是( )
| A、原电池中,负极上发生的反应是氧化反应 |
| B、原电池中,电流从负极流向正极 |
| C、铜锌原电池中放电时,溶液中的阴离子向负极移动,阳离子向正极移动 |
| D、碱性锰锌电池是一次电池,铅蓄电池是二次电池 |
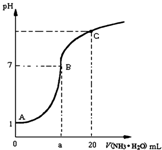 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |