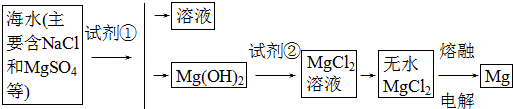
题目内容
工业上用CO2和NH3为原料合成尿素,尿素的化学式为CO(NH2)2.尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
(1)C、N、O三种元素的第一电离能由大到小的顺序是 .
(2)尿素分子中C和N原子的杂化方式分别是 .
(3)NH4+中H-N-H键角比NH3中H-N-H键角大,原因为 .
(1)C、N、O三种元素的第一电离能由大到小的顺序是
(2)尿素分子中C和N原子的杂化方式分别是
(3)NH4+中H-N-H键角比NH3中H-N-H键角大,原因为
考点:元素电离能、电负性的含义及应用,键能、键长、键角及其应用,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素;
(2)由尿素的结构式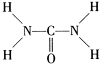 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
(3)排斥力:孤对电子-成键电子>成键电子-成键电子,排斥力大,键角被压缩.
(2)由尿素的结构式
 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;(3)排斥力:孤对电子-成键电子>成键电子-成键电子,排斥力大,键角被压缩.
解答:
解:(1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:N>O>C;
(2)由尿素分子的结构式 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;
(3)NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小,故NH+4中H-N-H键角大,
故答案为:NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小.
(2)由尿素分子的结构式
 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;(3)NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小,故NH+4中H-N-H键角大,
故答案为:NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小.
点评:本题考查核外电子排布规律、杂化轨道理论、价层电子对互斥理论等,难度不大,属于常考题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作中不正确的是(多选) ( )
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
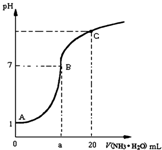 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- | ||
| B、水电离出的c(H+)=1×10-13的溶液:K+、Mg2+、NO3-、Cl- | ||
C、在
| ||
| D、甲基橙显红色的溶液:Na+、CO32-、NO3-、SO32- |
对于CH3COOH、HCl、H2SO4三种溶液,下列判断正确的是( )
| A、pH相同的三种溶液,物质的量浓度最小的是HCl |
| B、物质的量浓度相同的三种溶液,pH最小的是H2SO4 |
| C、含溶质的物质的量相同的三种溶液与过量镁粉反应,CH3COOH产生的H2最多 |
| D、相同pH、相同体积的三种溶液用NaOH溶液完全中和时,消耗NaOH溶液一样多 |
如图是周期表中短周期的一部分,A、C的原子序数之和等于B原子的原子序数.下列叙述正确的是( )
| A | C | |
| B |
| A、B的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中C的氢化物稳定性最好 |
| C、原子半径大小关系为:C>A |
| D、C的单质常温下为无色无味的气体 |
为了检验某FeCl2溶液是否变质,可选用的试剂是( )
| A、Fe粉 |
| B、Na2S溶液 |
| C、KSCN溶液 |
| D、石蕊试液 |