题目内容
根据下列化学反应和事实,说明反应利用了硫酸的什么性质,将表示性质的选项的字母填在各小题的横线上.
A.不挥发性 B.酸性C.吸水性 D.脱水性E.强氧化性 F.强酸性
(1)浓硫酸可作气体干燥剂 ;
(2)蔗糖中加浓H2SO4产生“黑面包”现象 ;
(3)Zn+H2SO4(稀)═ZnSO4+H2↑ ;
(4)Na2SO3+H2SO4(稀)═Na2SO4+SO2↑+H2O ;
(5)C+2H2SO4(浓)
2SO2↑+2H2O+CO2↑ .
A.不挥发性 B.酸性C.吸水性 D.脱水性E.强氧化性 F.强酸性
(1)浓硫酸可作气体干燥剂
(2)蔗糖中加浓H2SO4产生“黑面包”现象
(3)Zn+H2SO4(稀)═ZnSO4+H2↑
(4)Na2SO3+H2SO4(稀)═Na2SO4+SO2↑+H2O
(5)C+2H2SO4(浓)
| ||
考点:浓硫酸的性质
专题:元素及其化合物
分析:(1)浓硫酸具有吸水性,可用作干燥剂;
(2)浓硫酸具有脱水性,能使蔗糖碳化;
(3)Zn+H2SO4(稀)═ZnSO4+H2↑:反应的实质是锌与氢离子反应生成氢气和锌离子;
(4)亚硫酸酸性弱于硫酸,依据强酸制备弱酸规律解答;
(5)浓硫酸中硫元素化合价全部降低,表现氧化性.
(2)浓硫酸具有脱水性,能使蔗糖碳化;
(3)Zn+H2SO4(稀)═ZnSO4+H2↑:反应的实质是锌与氢离子反应生成氢气和锌离子;
(4)亚硫酸酸性弱于硫酸,依据强酸制备弱酸规律解答;
(5)浓硫酸中硫元素化合价全部降低,表现氧化性.
解答:
(1)浓硫酸可作气体干燥剂,体现浓硫酸的吸水性,
故答案为:C;
(2)蔗糖中加浓H2SO4产生“黑面包”现象,体现浓硫酸的脱水性;
故答案为:D;
(3)Zn+H2SO4(稀)═ZnSO4+H2↑:反应的实质是锌与氢离子反应生成氢气和锌离子,体现硫酸的酸性;
故答案为:B;
(4)Na2SO3+H2SO4(稀)═Na2SO4+SO2↑+H2O,由硫酸制取亚硫酸,体现硫酸的强酸性;
故答案为:F;
(5)碳与浓硫酸反应,浓硫酸中的硫元素化合价降低,表现氧化性;
故答案为:E.
故答案为:C;
(2)蔗糖中加浓H2SO4产生“黑面包”现象,体现浓硫酸的脱水性;
故答案为:D;
(3)Zn+H2SO4(稀)═ZnSO4+H2↑:反应的实质是锌与氢离子反应生成氢气和锌离子,体现硫酸的酸性;
故答案为:B;
(4)Na2SO3+H2SO4(稀)═Na2SO4+SO2↑+H2O,由硫酸制取亚硫酸,体现硫酸的强酸性;
故答案为:F;
(5)碳与浓硫酸反应,浓硫酸中的硫元素化合价降低,表现氧化性;
故答案为:E.
点评:本题考查了浓硫酸的性质,熟悉硫酸的性质是解题关键,注意浓硫酸吸水性与脱水性区别.

练习册系列答案
相关题目
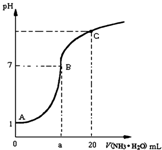 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- | ||
| B、水电离出的c(H+)=1×10-13的溶液:K+、Mg2+、NO3-、Cl- | ||
C、在
| ||
| D、甲基橙显红色的溶液:Na+、CO32-、NO3-、SO32- |
如图是周期表中短周期的一部分,A、C的原子序数之和等于B原子的原子序数.下列叙述正确的是( )
| A | C | |
| B |
| A、B的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中C的氢化物稳定性最好 |
| C、原子半径大小关系为:C>A |
| D、C的单质常温下为无色无味的气体 |
25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
| A、将水加热,KW增大,pH不变 |
| B、向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
| C、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D、向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
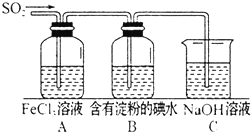 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: