题目内容
蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应为:NiO2+Fe+2H2O
Fe(OH)2+Ni(OH)2.下列有关该电池的说法中正确的是( )
| 放电 |
| 充电 |
| A、放电时电解质溶液显强酸性 |
| B、充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O |
| C、放电时正极附近溶液pH减小 |
| D、充电时阴极附近溶液的碱性保持不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由总反应式Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2可知,根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe,正极为NiO2,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-.原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应.
| 放电 |
| 充电 |
解答:
解:A、从放电和充电的反应式分析,此电池为碱性电池,故A错误;
B、放电时正极发生还原反应,正极反应式为NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是其逆反应发生,故B正确;
C、放电时正极发生还原反应,正极反应式为NiO2+2e-+2H2O=Ni(OH)2+2OH-,pH增大,故C错误;
D、充电时阴极反应式为Fe(OH)2+2e-=Fe+2OH-,溶液碱性增强,故D错误;
故选B.
B、放电时正极发生还原反应,正极反应式为NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是其逆反应发生,故B正确;
C、放电时正极发生还原反应,正极反应式为NiO2+2e-+2H2O=Ni(OH)2+2OH-,pH增大,故C错误;
D、充电时阴极反应式为Fe(OH)2+2e-=Fe+2OH-,溶液碱性增强,故D错误;
故选B.
点评:本题考查原电池和电解池的工作原理,题目难度中等,注意电解反应式的书写,为解答该题的关键,答题时注意体会.

练习册系列答案
相关题目
一定量的稀硫酸跟过量铁粉反应,为了减缓反应速率,又不影响生产氢气的总量,可向稀硫酸中加入适量的( )
| A、CH3COONa(固体) |
| B、NH4Cl(固体) |
| C、CuSO4(溶液) |
| D、Ba(OH)2(固体) |
下列说法不正确的是( )
| A、原电池中,负极上发生的反应是氧化反应 |
| B、原电池中,电流从负极流向正极 |
| C、铜锌原电池中放电时,溶液中的阴离子向负极移动,阳离子向正极移动 |
| D、碱性锰锌电池是一次电池,铅蓄电池是二次电池 |
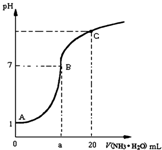 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |
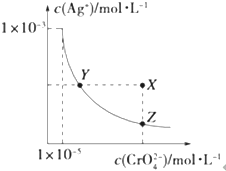 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )| A、t℃时,Ag2CrO4的Ksp为1×10-11 |
| B、饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 |
| C、t℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| D、t℃时,将0.01mol?L-1AgNO3溶液滴入20mL0.01mol?L-1KCl和0.01mol?L-1K2CrO4的混合溶液中,Cl-先沉淀 |
对于CH3COOH、HCl、H2SO4三种溶液,下列判断正确的是( )
| A、pH相同的三种溶液,物质的量浓度最小的是HCl |
| B、物质的量浓度相同的三种溶液,pH最小的是H2SO4 |
| C、含溶质的物质的量相同的三种溶液与过量镁粉反应,CH3COOH产生的H2最多 |
| D、相同pH、相同体积的三种溶液用NaOH溶液完全中和时,消耗NaOH溶液一样多 |
下列有关实验原理或操作正确的是( )
A、 如图装置可测定反应速率 |
| B、配制FeCl2溶液时,需加入少量铁粉和稀盐酸 |
| C、用碱式滴定管盛装KMnO4溶液滴定FeSO4溶液 |
| D、分别加热蒸干灼烧NaAlO2溶液和AlCl3溶液,最终都能得到Al2O3 |
