题目内容
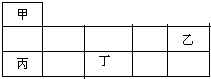 短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )
短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )| A、原子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,甲、乙、丙、丁分别是H、N、Na、Al元素,
A.电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的金属性越强,其单质的还原性越强;
C.只含共价键的化合物为共价化合物;
D.乙的最高价氧化物的水化物是硝酸、丙的最高价氧化物的水化物是NaOH、丁的最高价氧化物的水化物是氢氧化铝,氢氧化铝能溶于强酸和强碱.
A.电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的金属性越强,其单质的还原性越强;
C.只含共价键的化合物为共价化合物;
D.乙的最高价氧化物的水化物是硝酸、丙的最高价氧化物的水化物是NaOH、丁的最高价氧化物的水化物是氢氧化铝,氢氧化铝能溶于强酸和强碱.
解答:
解:根据元素在周期表中的位置知,甲、乙、丙、丁分别是H、N、Na、Al元素,
A.电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是丙>丁>乙,故A正确;
B.元素的金属性越强,其单质的还原性越强,金属性丙>丁>甲,所以单质的还原性:丙>丁>甲,故B错误;
C.只含共价键的化合物为共价化合物,甲和乙的氧化物中只含共价键,为共价化合物,丙的氧化物中含有离子键,为离子化合物,故C错误;
D.乙的最高价氧化物的水化物是硝酸、丙的最高价氧化物的水化物是NaOH、丁的最高价氧化物的水化物是氢氧化铝,氢氧化铝能溶于强酸和强碱,所以乙、丙、丁的最高价氧化物对应的水化物能相互反应,故D正确;
故选AD.
A.电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是丙>丁>乙,故A正确;
B.元素的金属性越强,其单质的还原性越强,金属性丙>丁>甲,所以单质的还原性:丙>丁>甲,故B错误;
C.只含共价键的化合物为共价化合物,甲和乙的氧化物中只含共价键,为共价化合物,丙的氧化物中含有离子键,为离子化合物,故C错误;
D.乙的最高价氧化物的水化物是硝酸、丙的最高价氧化物的水化物是NaOH、丁的最高价氧化物的水化物是氢氧化铝,氢氧化铝能溶于强酸和强碱,所以乙、丙、丁的最高价氧化物对应的水化物能相互反应,故D正确;
故选AD.
点评:本题考查元素周期表和元素周期律的综合应用,侧重考查推断、知识运用能力,明确元素周期表结构及元素性质、元素周期律知识即可解答,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
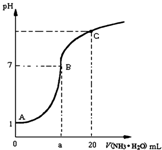 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |
下列有关实验原理或操作正确的是( )
A、 如图装置可测定反应速率 |
| B、配制FeCl2溶液时,需加入少量铁粉和稀盐酸 |
| C、用碱式滴定管盛装KMnO4溶液滴定FeSO4溶液 |
| D、分别加热蒸干灼烧NaAlO2溶液和AlCl3溶液,最终都能得到Al2O3 |
25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
| A、将水加热,KW增大,pH不变 |
| B、向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
| C、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D、向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
下列排序正确的是( )
| A、热稳定性:H2O>H2S>HF |
| B、酸性:NaHSO4>CH3COOH>H2CO3 |
| C、碱性:Ba(OH)2>Ca(OH)2>KOH |
| D、沸点:CH4>NH3>H2O |
为了检验某FeCl2溶液是否变质,可选用的试剂是( )
| A、Fe粉 |
| B、Na2S溶液 |
| C、KSCN溶液 |
| D、石蕊试液 |



 ).
).